
题目列表(包括答案和解析)
3 下列离子中,电子数>质子数且质子数>中子数的是
A D3O+ B Li+ C OD- D OH-
2 (2003全国理综)下列说法正确的是
A 非金属元素R形成的含氧酸盐(NaRO6)中的R元素必定呈现正价
B 只有非金属能形成含氧酸盐或含氧酸
C 除稀有气体外的非金属元素都能生成不同价态的含氧酸
D 非金属的最高含氧酸都具有强氧化性
可能用到的原子量:H 1 C 12 O 16 S 32 Mg 24 Ca 40 Cl 35.5 Na 23
一 选择题(本题包括10小题,每小题3分,共30分。每小题中有一个选项符合题意。)
1 下列化合物中只有共价键的是
A NaOH B NaCl C H2 D H2S
二 本题包括6小题,共50分
26 (3分)已知有1H216O、D2S、3H218O、S17O2、2H2S、S16O2,其中有_______种元素, 种原子, 种分子。
27 (7分)下表是元素周期表的一部分,按要求回答所列有关问题。
|
周期 |
族 |
|||||||
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
③ |
④ |
⑤ |
⑥ |
|
⑦ |
⑧ |
|
(1)在所示八种元素中,最活泼的非金属元素是 ,最活泼的金属元素是 。(均填元素符号)
(2)在所示八种元素的最高价氧化物对应的水化物中,酸性最强的酸是 ,碱性最强的碱是 ,呈两性的氢氧化物是 。(均填化学式)
(3)在所示八种元素中,原子半径最小的是 ,原子半径最大的是 。(均填元素符号)
28 (8分)(1)决定化学反应速率的主要因素是 ,影响反应速率的条件有 、 、 、 等。
(2)人们使用很多方法来保存食物,如用冰箱保存食物,这是因为 。
29 (8分)根据组成原电池的条件,试以反应:Fe+Cu2+==Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式。
供选用的电解质溶液有:稀硫酸、硫酸铜溶液、氯化铜溶液。
供选用的电极材料有:锌片、铜片、铁片、石墨。
电极材料及电极反应式:
负极材料: ,电极反应式:
正极材料: ,电极反应式:
电解质溶液: 。
30 (14分)现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
⑴A、B、C、D、E各是什么元素(写元素名称):
A______、B_____、C_____、D_______、E________ 。
⑵A的原子结构示意图___________,B的离子结构示意图_________
D的单质分子的电子式________, C元素最高价氧化物的水化物的电子式_______
⑶写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
___________________________,___________________
⑷比较B、C、E三种元素形成的简单离子其离子半径的大小和氧化性的强弱:(B、C、E离子用实际离子符号表示)
离子半径:____ ___ __;氧化性:_________ _________。
(5)写出E与冷水反应的化学方程式:
___________________ ________。
31 (10分)某课外兴趣小组欲探究铝与盐酸的反应实验中反应速率与哪些因素有关。请填写下列空白:
(1)实验原理: (用化学方程式表示)。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、 、 (填写所缺的实验用品);稀盐酸(4mol/L)、铝条(片)、水
 (3)实验装置 (图中铁架台等夹持仪器略去)
(3)实验装置 (图中铁架台等夹持仪器略去)
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性。
②取3块铝条加入到试管中。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。
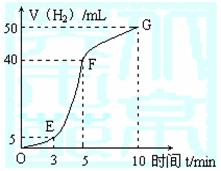
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG表示),并解释原因。
速率大小比较: ;
原因解释: 。
25 以下说法与电化学腐蚀无关的是
A 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B 生铁比软铁芯(几乎是纯铁)容易生锈
C 铁质器件附有铜质配件,在接触处易生铁锈
D FeCl3溶液与铜反应制作印刷电路板
24 下列各组微粒中,核外电子总数相等的是
A K+和Na+ B CO2 和 NO2 C CO和CO2 D N2 和CO
23 下列变化中属于吸热反应的是
① 液态水汽化 ② 将胆矾加热变为白色粉末 ③ 浓硫酸稀释
④ 氯酸钾分解制氧气 ⑤ 生石灰与水反应生成熟石灰
A ①④ B ②③ C ①④⑤ D ②④
22 碱性电池具有容量大、放电电流大的特点,因而得到广泛使用锌-锰碱性电池以KOH为电解质溶液,反应总式为:
Zn (s)+ 2 MnO2 (s)+ H2O(l) = Zn(OH) 2(s) + Mn2O3 (s)
下列说法错误的是
A 电池工作时,锌失去电子
B 电池正极反应式为2 MnO2 (s)+ H2O(l) + 2e- = Mn2O3 (s) + 2OH-(aq)
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过0.2mol电子,锌的质量理论上减少6.5克
21 下列各组物质气化或熔化时,所克服的微粒间的作用力属同一种类型的是
A 碘和干冰的升华 B 氯化钠和氯化氢溶于水
C 氯化钠和冰的熔化 D 水和钠的汽化
11 下列各项比较中正确的是
A 熔沸点:I2>Br2>Cl2>F2 B 稳定性: HI>HBr>HCl
C 还原性:HCl>HBr>HI D 还原性:F2>Cl2>Br2>I2
12 某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断
A R一定是第四周期元素 B R一定是ⅣA族元素
C R的气态氢化物的化学式为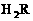
D R的气态氢化物比同周期其它元素气态氢化物均稳定
13 某物质中只含有一种元素,则该物质是
A 一定是一种单质 B 一定是一种纯净物
C 一定是混合物 D 可能是纯净物也可能是混合物
14 一种比黄金贵百倍的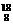 O2气体,近年在兰州近代物理研究所研制成功,有关
O2气体,近年在兰州近代物理研究所研制成功,有关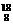 O2气体的下列说法中正确的是
O2气体的下列说法中正确的是
A 它是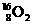 的一种同素异形体 B 它是
的一种同素异形体 B 它是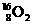 的核素
的核素
C  与
与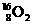 互为同位素 D 氧气中含有
互为同位素 D 氧气中含有 分子,仍属纯净物
分子,仍属纯净物
15 下列关于化学键的说法正确的是
A 构成单质分子的微粒一定含有共价键
B 全部由非金属元素组成的化合物不一定是共价化合物
C 非极性键只存在于双原子单质分子中
D 不同元素组成的多原子分子里的化学键一定都是极性键
16 反应4NH3(气)+5O2(气) ===4NO(气)+6H2O(气)在10L容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,此反应的平均速率V(X)(反应物的消耗速率或产物的生成速率)可表示为
A v (NH3)=0.010mol/L·S B v (O2)=0.0010mol/L·S
C v (NO)=0.0010mol/L·S D v (H2O)=0.045mol/L·S
17 镍-镉可逆电池的反应式为:Cd+2NiO(OH)+2H2O==Cd(OH)2+2Ni(OH)2,其电极的正极材料是
A Cd B NiO(OH) C Cd(OH)2 D Ni(OH)2
18 下列反应中,产生氢气速度最快的是
A 常温下铝与6mol/L的硝酸反应 B 常温下镁与3mol/L的醋酸反应
C 常温下铁与3mol/L的盐酸反应 D 常温下镁与3mol/L的硫酸反应
19 有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
A D>C>A>B B D>A>B>C C D>B>A>C D B>A>D>C
20 下列说法正确的是
A 非金属元素呈现的最高化合价不超过该元素的原子的最外层电子数
B 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C 最外层有2个电子的原子都是金属原子
D 最外层有1个电子的原子都是金属原子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com