
题目列表(包括答案和解析)
1、短周期元素R的原子核外电子数等于核内中子数,该元素单质7.8g与氧气充分反应可生成13g化合物RO,则该元素的价电子层是:
A、1S2 B、2S2 C、3S2 D4S2
22 (10分)有A、B、C、D、E五种微粒,其组成均有氢元素,且电子总数为10个,A是双原子的阴离子,它们之间能发生下列变化:
(1)A+B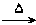 C+D↑ (2)C+C
C+D↑ (2)C+C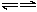 A+E
(3)D+E
A+E
(3)D+E B+C
B+C
由此可知它们的化学式分别为:
A ,B ,
C ,D ,E 。
23 (8分)在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期律有着密切的关系,约占人体总质量99.97%的11种宏量元素,全部位于元素周期表中前20号元素之内,其余0.03%是由十多种人体不可缺少的微量元素组成。在微量元素中,只有F和Si位于短周期,其余均属第一长周期。在宏量元素中,除H、N、P外,在现用的周期表里还有的元素是:(写元素符号)
(1) 原子最外层电子数是次外层电子数2倍的是 ;
(2) 最高价氧化物对应水化物酸性最强的元素是 ,跟它处在同一周期的还有一种非金属元素是 ;
(3) 原子半径最大的元素是 ,跟它相邻的两种元素是 ;
(4) 剩余的两种元素,它们的离子电子层结构均与Ne的相同,且带电量也相同,但符号相反的两种元素是 和 。
四 本题包括3小题,共44分
24 (10分)解释钾投入水中发生下列现象的原因:
① 钾与水剧烈反应_____________________ ;
② 钾浮在水面上___________________________ ;
③ 钾熔化成火球____________________________ ;
④ 火球在水面上游动___________ ___ ;
⑤ 反应后的溶液中滴入酚酞变红_________________ 。
25(12分)验证周期表中元素性质的变化规律:(1)同一周期内从左到右元素的金属性逐渐减弱;(2)同一主族内从上到下元素的非金属性逐渐减弱。从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中。(不一定全选)
|
实验方法(Ⅰ) |
实验现象(Ⅱ) |
|
A.钠与冷水反应 |
a.溶液变红色 |
|
B.向NaOH溶液中滴加酚酞 |
b.产生白烟 |
|
C.点燃H2S |
c.反应不十分剧烈,产生的气体能燃烧 |
|
D.蘸浓氨水与浓盐酸的两玻璃棒接近 |
d.浮于水面,熔成小球,迅速向四处游动 |
|
E.NaI溶液中加入溴水 |
e.生成白色胶状沉淀,后又溶解 |
|
F.镁带与沸水反应 |
f.产生大量气泡、气体可以点燃 |
|
G.AlCl3溶液中加入NaOH溶液 |
g.溶液变棕黄色 |
|
H.NaCl溶液中加入溴水 |
h.发出耀眼的强光,生成白色物质 |
|
I.镁带空气中燃烧 |
i.发出淡蓝色火焰 |
|
J.NaBr溶液中加入氯水 |
j.观察不出什么现象 |
|
K.铝片与2mnol/L盐酸反应 |
k.溶液变橙色 |
答案:
|
|
(1)同周期 |
(2)同主族 |
|
Ⅰ |
|
|
|
Ⅱ |
|
|
解释在同一周期内从左到右金属性逐渐减弱的原因:
。
26 (16分)下表是元素周期表的一部分, 针对表中的①-⑨种元素,填写下列空白:
|
主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
|
2 |
|
|
|
① |
② |
③ |
|
|
|
3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
|
|
(1) 在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是___ _,碱性最强的化合物的电子式是____ ______;
(3) 用电子式表示元素⑦的单质分子的形成过程: ;
(4) 用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦形成的化合物的电子式 ,该化合物含的共价键类型是 。
27 (8分)A,B,C,D,E五种元素,它们的原子序数依次增大,A原子最外层有4个电子。B的阴离子与C的阳离子跟氟离子的电子层结构相同。E原子的M层上的电子数比次外层少1个电子。常温、常压下B单质是气体,0.1mol单质B与氢气完全反应时,有2.408×1023个电子发生转移。C的单质在高温下与B的单质充分反应之后,生成淡黄色固体F,F与AB2反应后可生成单质B。D的氢化物化学式是H2D,D的最高氧化物中含有40%的D,而且D原子是由相同数目的质子、中子、电子组成,根据以上的已知条件进行推测:
(1)下列元素的名称:D ,E 。
(2)写出下列的化学方程式:
B+C→F: ;
F与AB2反应: 。
五 选做题,本题共10分
28 0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子,0.4gX的单质与足量盐酸反应放出0.02g氢气;X中中子数和质子数相等;Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸。
(1)推断X、Y两元素在周期表中的位置;
(2)用化学方程式表示X最高价氧化物对应的水化物与Y单质的反应。
29 某元素X的碳酸氢盐 [X(HCO3)2] 在高温下完全分解的产物都是氧化物,现取3.24g这种碳酸氢盐高温完全分解后得到1.12g固体,又知X的原子核里有20个中子。
(1)通过计算确定X是什么元素,并写出它在元素周期表中的位置;
(2)写出X的单质与水反应的化学方程式,已知该元素的金属性比钠强,但其单质与水反应没有钠那样剧烈,试分析其原因。
六、延伸拓展题(根据自己的能力决定是否完成)
30 (20分)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:① 元素周期表中,Z与Y相邻,Z与W也相邻;② Y、Z和W三种元素的原子最外层电子数之和为17。
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”) ,理由是 。
(2)Y是 Z是 W是 。
(3)X、Y、Z、W可能组成一化合物,其原子个数之比为8:2:4:1,写出该化合物的名称及化学式。
2006-2007学年第二学期第一次月考题(3月30日)
三 本题包括3小题,共26分
21 (8分)过氧化氢(H2O2)又叫双氧水,其水溶液可用于工业上的漂白剂、特殊环境里燃烧的助燃剂、医疗上的消毒剂、实验室里的制氧剂、过氧原子团由2个氧原子共用1对电子组成。
(1)分别写出H2O2、Na2O2的电子式。
(2)H2O2与Na2O2相比,化学键更稳定的是 ,主要依据是
18 核电荷数为1-18的X和Y两元素,X元素原子的最外层电子数与次外层电子数差的绝对值等于电子层数;Y元素比X元素的原子多2个最外层电子。 则X与Y不可能形成的化合物是:
A X2Y B XY2 C XY3 D XY
19 下列各项比较中正确的是
A 熔沸点:I2>Br2>Cl2>F2 B 稳定性: HI>HBr>HCl
C 还原性:HCl>HBr>HI D 氧化性:F2>Cl2>Br2>I2
20 短周期元素A、B、C 原子序数依次递增,它们原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述正确的是:
A 原子半径A<B<C
B A的氢化物的稳定性大于C的氢化物
C B的最高价氧化物的对应水化物呈碱性
D A与C可形成离子化合物
|
电子85个,E原子核外有4个电子层,则B元素为( )
A Si B P C S D Cl
15 下列事实不能用来判断金属性强弱的是( )
A 金属间发生置换反应
B 1mol金属单质在反应中失去的电子数
C 金属元素的最高价氧化物的水化物的碱性强弱
D 金属单质与水或酸反应置换出氢的难易
16 下列变化中离子键受到破坏的是( )
A NaOH溶于水 B HCl溶于水
C O2溶于水 D I2升华
17 已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4,则下列判断正确的是
A 气态氢化物的稳定性:HX>H2Y>ZH3
B 非金属活泼性:X<Y<Z
C 原子半径:X>Y>Z
D 原子最外层上电子数的关系:Z=1/2(X+Y)
10 下列叙述正确的是
A 同周期元素的原子半径以ⅦA族的为最大
B 同主族两种元素的原子核外电子数的差值可能为26
C 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
D 科学家在周期表中金属与非金属分界处找到了优良的催化剂
二 选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题就为0分。)
11 X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是
A R一定是共价化合物
B R一定是离子化合物
C R可能是共价化合物,也可能是离子化合物
D R可能是气态物质,也可能是固态物质
12 A、B、C三种元素的原子序数依次为a、b、c,它们的离子A没+、Bn-、Cm-具有相同的电子层结构,且n > m ,则下列关系正确的是
A a > b > c B a > c > b
C a = b + m + n D a = c – n – m
13 下列关于化学键叙述正确的是
A 离子化合物可以含共价键。
B 共价化合物可以含离子键
C 离子化合物中只含离子键
D 共价化合物中不含离子键
7 元素性质呈现周期性变化的根本原因是
A 元素的相对原子质量递增,量变引起质变
B 元素原子的核外电子排布呈周期性变化
C 元素的原子半径呈周期性变化
D 元素的化合价呈周期性变化
8 YBa2Cu8Ox(Y元素钇)是悬浮列车中的重要超导材料,关于3989Y的说法不正确的是
A 属于金属元素 B 质子数与中子数之差为50
C 原子的核外电子数是39 D 3989Y和3990Y是两种不同的核素
9 下列分子含有的电子数目与HF相同,且只有两个极性共价键的是
A CO2 B N2O C H2O D CH4
6 铍的性质类似铝,下列有关铍的性质正确的是
A 铍能与冷水反应 B 氧化铍的化学式为Be2O3
C 氢氧化铍能与强酸、强碱反应
D 氧化铍只溶于强酸溶液,不溶于强碱溶液。
5 意大利科学家用O2和O2+制造出了一种新型氧分子O4,下列叙述正确的是
A 16O、18O2+都是氧元素的同位素
B O2、O2+、O4都是O3的同位素
C O4是新型的氧化物
D 制造O4的反应是氧化还原反应
4 下列说法错误的是
A 金属性 Rb>K>Mg>Al B 非金属性 As<S<Cl<F
C 稳定性 AsH3>PH3 >H2S>HF D 原子半径 Na>P>O>F
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com