
题目列表(包括答案和解析)
三 本题包括3小题,共27分
21 (14分)(1)决定化学反应速率的主要因素是 ,影响反应速率的条件有 、 、 、 等。
(2)人们使用很多方法来保存食物,如用冰箱保存食物,这是因为 。
(3)已知有1H216O、D2S、3H218O、S17O2、2H2S、S16O2,其中有_______ 种元素, 种原子, 种分子。
22 (10分)根据组成原电池的条件,试以反应:Fe+Cu2+==Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式。
供选用的电解质溶液有:稀硫酸、硫酸铜溶液、氯化铜溶液。
供选用的电极材料有:锌片、铜片、铁片、石墨。
电极材料及电极反应式:
负极材料: ,电极反应式:
正极材料: ,电极反应式:
电解质溶液: 。
23 (3分)已知元素的电负性和元素的化合价、原子半径等一样,也是元素的一项基本性质,下表中列出了14种元素的电负性:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
Mg |
N |
Na |
|
电负性 |
1.5 |
2.0 |
2.5 |
2.5 |
2.8 |
4.0 |
1.0 |
1.2 |
3.0 |
0.9 |
|
元素 |
O |
P |
S |
Si |
|
|
|
|
|
|
|
电负性 |
3.5 |
2.1 |
2.5 |
1.7 |
|
|
|
|
|
|
请分析判断表中信息的规律,说明不同元素之间电负性变化的规律是
。
8 下列晶体或分子中,含有化学键类型有差异的一组是
A H2O、CO2 B MgF2、H2O2
C NaOH、Ba(OH)2 D NaCl、KCl
9 下列各分子中,所有原子都满足最外层为8电子结构的是
A H2O B BF3 C CCl4 D HCl
10 随着核电荷数的递增,氧化性逐渐减弱的一组是 A I2 、Br2 、Cl2 、F2 B F2 、Cl2 、Br2、I2
C F- 、Cl- 、Br-、I- D Li、Na、K、Rb
二 选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个,该小题就为0分)
11 关于如图所示装置的叙述,正确的是
 A 两装置中锌片都发生氧化反应
A 两装置中锌片都发生氧化反应
B 两装置中溶液的pH均增大
C 两装置中铜片的质量均逐渐减小
D 两装置中铜片表面均无气泡产生
12 航天技术上使用一种氢氧燃料电池,它具有高能轻便、不污染环境等优点,该电池总反应方程式为:2H2+O2═2H2O,该电池的正极反应可表示为
A 4H++4e-═2H2↑ B O2+2H2O+4e-═4OH―
C 4OH―-4e-═O2↑+2H2O D 2H2-4e-═4H+
13 下列物质的变化过程,属于吸热变化的是
A 干冰(CO2晶体)汽化 B NaOH溶于水
C 浓H2SO4溶于水 D CO燃烧
14 下列反应中,产生氢气速度最快的是
A 常温下铝与6mol/L的硝酸 B 常温下镁与3mol/L的醋酸
C 常温下铁与3mol/L的盐酸 D 常温下镁与3mol/L的硫酸
15 反应4NH3(气)+5O2(气) 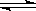 4NO(气)+6H2O(气)在10L容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,此反应的平均速率V(X)(反应物的消耗速率或产物的生成速率)可表示为
A v (NH3)=0.010mol/L·s B v (O2)=0.00125mol/L·s
4NO(气)+6H2O(气)在10L容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,此反应的平均速率V(X)(反应物的消耗速率或产物的生成速率)可表示为
A v (NH3)=0.010mol/L·s B v (O2)=0.00125mol/L·s
C v (NO)=0.0010mol/L·s D v (H2O)=0.045mol/L·s
16 可逆反应N2+3H2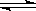 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A 3v正(N2)=v正(H2) B v正(N2)=v逆(NH3)
C 2v正(H2)=3v逆(NH3) D v正(N2)=3v逆(H2)
17 无机化学命名委员会(国际组织)在1999年作出决定,把长式周期表原先的主副族序号取消,由左到右按原顺序编为18列,稀有气体为第18列,按这个规定,下列说法正确的是
A 第三列所含元素最多
B 从上到下第一列元素单质熔点逐渐升高,而第17列元素单质熔点逐渐降低
C 从上到下第一列元素单质密度逐渐升高,而第17列元素单质密度逐渐降低
D 第18列最外层电子数均为8,化学性质十分稳定
 18 在一定温度下,向a L密闭容器中加入1molX气体和2 molY气体,发生如下反应:X(g) + 2Y(g) 2Z(g)此反应达到平衡的标志是
18 在一定温度下,向a L密闭容器中加入1molX气体和2 molY气体,发生如下反应:X(g) + 2Y(g) 2Z(g)此反应达到平衡的标志是
A 容器内压强不随时间变化
B 容器内各物质的浓度不随时间变化
C 容器内X、Y、Z的浓度之比为1∶2∶2
D 单位时间消耗0.1molX同时生成0.2molZ
19 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A 电池工作时,锌失去电子
B 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
20 下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是
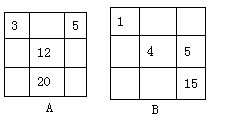 |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
7 若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是
A 1 B 3 C 5 D 6
6 下列哪个事实能说明氯化氢是共价化合物
A 氯化氢溶于水 B 液态氯化氢不导电
C 氯化氢溶于水发生电离 D 氯化氢不易分解
5 下列各组指定的原子序数的元素,不能形成XY2型化合物的是
A 6和8 B 16和8 C 12和9 D 11和16
4 100ml2mol/L的盐酸与过量的锌反应,为加快反应速率,又不影响氢气的总量,可采用的方法是
A 加入适量的6mol/L盐酸 B 加入数滴氯化铜溶液
C 加入适量的蒸馏水 D 加入适量的氯化钠溶液
3 铁在下列情况下腐蚀最快的是
A 铁放入海水中 B 铁和锌连接放入海水中
C 铁和锡连接放入海水中 D 铁和锡连接放入淡水中
2 下列化合物中,阴离子和阳离子半径之比最大的是
A CsI B NaI C LiI D KCl
一 选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1 化学反应中能量变化的根本原因是
A 反应温度的改变 B 化学键的断裂和形成
C 分子间距离的变化 D 物质组成发生变化
26.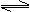 (6分)在一密闭容器中(容积为5L),充入5mol氨气和10mol氧气,并发生如下反应:4NH3+5O2 4NO+6H2O(g),此反应在一定条件下进行2min后,测得NH3为4mol,试求:
(6分)在一密闭容器中(容积为5L),充入5mol氨气和10mol氧气,并发生如下反应:4NH3+5O2 4NO+6H2O(g),此反应在一定条件下进行2min后,测得NH3为4mol,试求:
⑴以NO的浓度变化表示该反应的平均反应速率。
⑵O2在2min时的浓度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com