

题目列表(包括答案和解析)
25、(9分)Cu与稀硝酸发生如下反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。将19.2g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应。假定溶液体积不变,请回答下列问题:
(1)在上述反应中, 作氧化剂,发生转移的电子的物质的量为: ;
(2)写出Cu与稀硝酸反应的离子方程式 ;
(3)生成的NO气体的体积(标准状况);硝酸的物质的量浓度。
24、(10分)甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钡、硝酸银4种溶液
中的一种。将他们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也都产生沉淀;③乙与丁混合产生无色气体。回答下面问题:
(1)这四种溶液分别是 甲:_______ 乙:_____
丙:_____________ 丁:____________。
(2)写出下列各组合反应的离子方程式:
甲-乙: ; 丙-丁: ; 乙-丁:
23、(6分)同温同压下,等体积的N2和NH3相比较,
(1)它们所含的分子数目之比为 ;
(2)它们所含的N原子数目之比为 ;
(3)它们所含的原子总数目之比为 ;
22、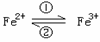 (6分)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(6分)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1)在人体中进行 的转化时,①中的Fe2+作_________剂,
②中的Fe3+作_________剂。
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素在这一反应中作______________剂,具有_______________性。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉。这些铁粉在人体胃酸(主要成份是盐酸)的作用下转化成亚铁盐。写出反应的化学方程式,标出电子转移的方向和数目:____________ 。
21、(4分)取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为____________________________________,反应后得到的FeCl3溶液呈棕黄色。用此溶液进行以下实验:
(1) 取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀
生成,发生的离子方程式___________________________________。
(2) 在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴
FeCl3溶液,继续煮沸至溶液呈褐色,即可制得Fe(OH)3胶体。
20、(4分)15.6gNa2X含Na+ 0.4mol,则Na2X的摩尔质量为 ,X的相对原子质量为 。
19、(4分)按要求完成下列填空:
(1)写出硫酸铁在水溶液中的电离方程式
(2)写出符合离子方程式Ba2++SO42- =BaSO4↓的一种化学方程式
18、在下列条件下,两种气体的分子数一定相等的是
A.同质量的不同密度的N2和C2H4 B.同体积同温度的NO和C2H6
C.同温度同压强的CO和N2 D.同体积同密度的CO和C2H4
第Ⅱ卷(非选择题)
17、重金属离子具有毒性,实验室中有甲、乙两种重金属离子的废液,甲废液
经化验呈碱性,主要的有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,
毒性明显降低。则乙废液中可能含有的离子是
A.K+和SO42- B.Ag+和NO3-
C.Cu2+和SO42 - D.Cu2+和Cl-
16、能正确表示下列反应的离子方程式的是
A.铜片插入硝酸银溶液中 Cu +2Ag+ = Cu2+ + 2Ag
B.氢氧化钡溶液与硫酸反应:SO42- +H+ +Ba2+ +OH-=BaSO4↓+H2O
C.氢氧化铁与稀硫酸反应: Fe(OH)3 + 3H+ = Fe3+ + 3H2O
D.把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com