
题目列表(包括答案和解析)
2、下列实验操作中,正确的是 ( )
A、配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B、配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
1、科学家最近发现2种粒子:第1种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是: ( )
A、“四中子”不显电性 B、“四中子”的质量数为4
C、第2种粒子是氧元素的另一种同位素 D、第2种粒子的化学式为O4
34.(6分)取一定量的某气态烃完全燃烧后,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重2.25g,碱石灰增重4.4g。已知该烃在标准状况下的密度是2.59g/L。
⑴求该烃的分子式。
⑵又知1g该气态烃完全燃烧生成CO2气体和液态水时释放出49.6kJ的热量,写出该气态烃燃烧的热化学方程式。
33.(6分)在25℃时,将7.2g镁条放入过量的100mL稀盐酸中。反应开始至1min末收集到氢气2.24L(标准状况下),1min末到2min末时镁条减少3.6g,在此之后,又经过2min镁条全部溶解,假设反应前后溶液体积始终为100mL,则:
⑴在反应开始至1min末时间用MgCl2表示的平均反应速率为多少?
⑵在1min末到2min时间用HCl表示的平均反应速率为多少?
⑶比较0-1min,1min-2min,2min-4min,三段时间的反应速率的大小,并解释原因。
32.(6分)某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
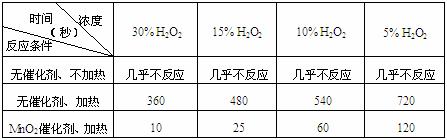
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解
速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
。
⑵将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
|
催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
|
粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
|
块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2发生的化学反应方程式_______________ _________。
②实验结果说明催化剂作用的大小与________ ________________有关。
⑶若已知1 克液态过氧化氢分解成氧气和液态水时,可放出2.89kJ能量,写出该反应的热化学方程式: 。
31.(6分)不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。下面是某些短周期元素的x值:
|
元素 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
⑴通过分析x值变化规律,确定Mg的x值范围: < x(Mg) < ;
⑵推测x值与原子半径关系是 ;
根据短周期元素的x值变化特点,体现了元素性质的 变化规律。
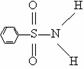
⑶某有机化合物结构式为 ,其中S-N中,你认为共用电子对偏向谁?
(写原子名称)。
⑷经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx < 1.7,一般为共价键,试推断:AlCl3中化学键类型是 。
30.(5分)对右图中加以必要的连接并填空:
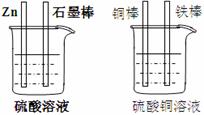 ⑴现有如右图所示两个烧杯,画出必要的连线,使连
⑴现有如右图所示两个烧杯,画出必要的连线,使连
接后的装置能达到在铁棒上镀上一层铜的目的。
⑵分别写出石墨棒和铜棒的电极反应式
石墨棒:
铜棒:
⑶若锌减少了6.5g,则在铁棒上镀上Cu的质量为 。
29. (5分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
⑴A的元素符号为: O ;D的原子结构示意图是:Cl的原子结构示意
⑵A、B、C三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) S2- > O2
⑶A、B、C、D形成的化合物B2A2、CD2、D2A中各原子都满足最外层8电子结构的是 NaO SCl Cl (填写具体的化学式 ),写出CD2的电子式: 。
28.(7分)现有①BaCl2 ②金刚石 ③ 金属铜 ④KOH ⑤干冰 ⑥固态氮气⑦二氧化硅⑧白磷⑨K2O⑩NH4Br六种物质,按下列要求回答(填序号):
⑴熔化时需要破坏共价键的是________;⑵既含有共价键又含有离子键的是 ;
⑶属于共价分子单质的是 ;⑷属于金属晶体的是_____ _______ ;
⑸化学式只表示粒子数目的最简比,且比值为1:2的是 ;
⑹写出⑤和⑩的电子式,⑤ ,⑩ 。
27.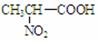 (5分)将下列物质进行分类:①
(5分)将下列物质进行分类:①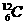 与
与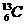 ;②石墨与富勒烯;③乙烷与辛烷;④硝基丙烷(CH3CH2CH2-NO2)与丙氨酸(
);⑤CH3CH2CH2CH3和(CH3)2CHCH3;⑥天然气的主要成分与沼气的主要成分;⑦一氯甲烷与二氯甲烷;⑧HF与HCl。并对各组物质的性质异同点进行分析,用数字序号回答问题:
;②石墨与富勒烯;③乙烷与辛烷;④硝基丙烷(CH3CH2CH2-NO2)与丙氨酸(
);⑤CH3CH2CH2CH3和(CH3)2CHCH3;⑥天然气的主要成分与沼气的主要成分;⑦一氯甲烷与二氯甲烷;⑧HF与HCl。并对各组物质的性质异同点进行分析,用数字序号回答问题:
⑴互为同素异形体的是 ;⑵互为同分异构体的是 ;
⑶互为同位素是 ;⑷属于同一化合物的是 ;
⑸互为同系物的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com