
题目列表(包括答案和解析)
4、金属钠长期露置于空气中,最后变为 ( )
A、Na2O B、Na2O2 C、NaOH D、Na2CO3
3、下列关于铷的叙述中,不正确的是 ( )
A、原子半径比钾的大 B、碳酸铷加热易分解为氧化铷和二氧化碳
C、氯化铷属于离子化合物 D、铷的盐类大多易溶于水
2、下列实验操作中,正确的是 ( )
A、配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B、配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
1、科学家最近发现2种粒子:第1种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是: ( )
A、“四中子”不显电性 B、“四中子”的质量数为4
C、第2种粒子是氧元素的另一种同位素 D、第2种粒子的化学式为O4
23 (8分)现有Na2CO3和NaHCO3的混合固体19.0 g,将其加热至质量不再减少时,冷却,称量,发现固体质量变为15.9 g。求原混合固体中Na2CO3和NaHCO3的质量分别为多少克?
24(10分)将一充满NO2和O2混合气体的试管倒立于水中,若试管的容积为10ml,充分反应后剩余气体为1ml,求原混合气体中NO2和O2的体积各为多少毫升?
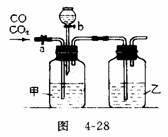 21(7分)某学生用图4-28的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。
21(7分)某学生用图4-28的装置进行一氧化碳和二氧化碳混合气体的分离和干燥。其中a为铁夹,b为分液漏斗的活塞。
(1)甲瓶内盛 溶液,乙瓶内盛 溶液,分液漏斗内盛 溶液。
(2)实验先分离出一氧化碳,方法是先关闭 ,再打开 。
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭 ,再打开 。
22 (6分) 甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银四种溶液中的一种,将它们两两混合后,观察到如图所示的现象,其中丁与乙产生的是无色气体。
|
|
甲 |
乙 |
丙 |
丁 |
|
甲 |
- |
↓ |
↓ |
- |
|
乙 |
↓ |
- |
↓ |
↑ |
|
丙 |
↓ |
↓ |
- |
↓ |
|
丁 |
- |
↑ |
↓ |
- |
请回答下列问题:
⑴写出丁与乙反应的离子方程式
⑵这四种溶液中溶质的化学式分别是:甲 ,乙 ,丙 ,丁 。
16 (6分)若实验室用氯水和KSCN溶液检某溶液中有无Fe2+,应在待测试液中先加入 、后加入 。若看到 ,说明含Fe2+。
17(8分)有一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)溶液中加入一定量Ba(OH)2(强碱)溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
(5)向(4)的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
根据上述实验,这包粉末中一定不含有的离子是 ,肯定含有的离子是
,不能确定是否含有的离子是 ,可通过 来进一步确定该离子。
18(8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
19(6分)(1)正常雨水显 性,其pH约值等于 ,这是由于 ____ 。
(2)某次采集的酸雨样品,每隔一段时间测定一次pH值,得数据如下
|
时间 |
开始 |
8h后 |
16h后 |
24h后 |
32h后 |
40h后 |
48h后 |
|
pH |
5.0 |
4.8 |
4.6 |
4.3 |
4.2 |
4.0 |
4.0 |
酸雨样品pH值变小的主要原因是
。
20(6分)(市一中做)某无色透明溶液,跟金属铝反应生成H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、SO32-、HCO3-、、OH-、NO3-,哪些可能是构成此溶液的成分?
(1)生成Al3+时,可能存在
(2)当生成AlO2-时,可能存在
20(6分)(大丰中学做)X、Y、Z、W四种元素,都位于周期表中的短周期,且原子序数X<Y<Z<W。X原子和Y原子的最外层电子数之和与Z原子最外层电子数相等。X的原子半径为自然界元素中原子半径最小的。W原子和Y原子最外层电子数之和为Z原子最外层电子数的2倍。W原子最外层电子数为其电子层数的3倍。⑴这四种元素的名称分别为:X ,Y ,Z ,W 。⑵由这四种元素可组成某种盐,该盐既能与盐酸反应,又能与氢氧化钠溶液反应。该盐的化学式为
15、将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为 ( )
A、0.05 mol B、1mol C、1.05mol D、0.13mol
第II卷(非选择题 65分)
14、往100 mL 1mol/L的AlCl3溶液中滴加1mol/L的NaOH溶液,得到5.85g沉淀,则加入NaOH溶液的体积可能是 ( )
A、200 mL B、225mL C、300 mL D、325 mL
13、某溶液中有NH4+、Mg2+、Fe2+、和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 ( )
A、NH4+ B、Mg2+ C、Fe2+ D、 Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com