
题目列表(包括答案和解析)
3、下列气态氢化物中最不稳定的是:
A.HCl B.H2S C.PH3 D.NH3
2、现有①K2SO4;②Ba(NO3)2;③Al2(SO4)3;④ KOH;⑤CuCl2五种溶液。不用其他任何试剂,把它们一一鉴别出来的顺序是:( )
A.①②③④⑤ B.⑤④③②① C.⑤④①②③ D.②③④①⑤
1、NA代表阿伏加德罗常数。下列说法正确的是:( )
A.常温常压下,11.2L氧气中所含的原子数目为NA
B.9g重水(D2O)含有的电子数为5NA
C.含NA个氧气分子和含NA个臭氧分子的质量相等
D.25℃时,17g氨气所含电子数为10NA
10、(14分)几种短周期元素的原子半径及某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
化合价 |
–1 |
–2 |
+4、–4 |
+4、–2 |
+5、–3 |
+3 |
+2 |
+1 |
|
原子半径/nm |
0.071 |
0.074 |
0.077 |
0.102 |
0.110 |
0.143 |
0.160 |
0.186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题。涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族;
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号) ;
(3)A与J所形成化合物类型是 ,用电子式表示其形成过程 ;
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为 __________ ;D与B形成的某种化合物Y不仅能与X反应,还能与I的单质反应,则Y与I的单质反应的化学方程式为 。
练 习 三
选择题(本题包括 8小题,每小题只有一个选项符合题意,每小题6分,共48分)
9、(8分)NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点。NO亦被称为“明星分子”,试回答下列问题:
(1)NO对环境的危害在于 (填以下项目的编号)。
A.破坏臭氧层
B.高温下能使一些金属被氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含Cu+离子酶活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝根离子在酸性水溶液中反应的离子方程式 。
(3)在常温下,将NO气体压缩到1.01×107Pa,在一个体积固定的容器里加热到50℃。发现气体的压强迅速下降,压强降至略小于原压强2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式。________________________________________________
8、下列离子方程式中正确的是:( )
A.往NaHSO4溶液中逐滴滴入Ba(OH)2溶液至恰好完全沉淀:
Ba2+ + 2OH- + 2H+十SO42- = BaSO4↓ + 2 H2O
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2+ + HCO3-+2OH-= CaCO3↓ + CO32- + 2H2O
C.Na2CO3溶液中通入少量CO2:CO32- + CO2 + H2O = 2HCO3-
D.CH3COOH溶液与NaOH溶液反应:H++ OH- = H2O
7、能正确表示下列反应的化学方程式是( )
A.黄铁矿煅烧:2FeS2+5O2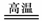 FeO+4SO2
FeO+4SO2
B.石英与石灰石共熔:SiO2+CaO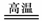 CaSiO3
CaSiO3
C.氨的催化氧化:4NH3+5O2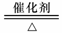 4NO+6H2O
4NO+6H2O
D.氯气与石灰乳反应:2Cl2+2Ca(OH) 2 = CaCl2+CaClO2+2H2O
6、两种短周期元素的化合物中,原子个数比为1∶3,若两种元素的原子序数分别为a和b,
则a和b的关系可能是:( )
①a=b+5 ②a+b=8 ③a+b=30 ④a=b+8
A.①②③④ B.只有②③④ C.只有②③ D.只有③④
5、NaF、NaI、MgO均为离子化合物,现有下列数据,试判断这三种化合物的熔点高低顺序:( )
|
物 质 |
① |
② |
③ |
|
离子电荷数 |
1 |
1 |
2 |
|
键长(10-10m) |
2.31 |
3.18 |
2.10 |
A.①>②>③ B.③>①>② C.③>②>① D.②>①>③
4、SO42-和S2O82-的结构中,硫原子均位于由氧原子组成的正四面体的中心,且所有原子最外层都满足8个电子结构。下列说法正确的是:( )
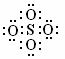
A.SO42-的电子式为: B.S2O82-没有非极性键
C.S2O82-比SO42-稳定 D.S2O82-有强氧化性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com