
题目列表(包括答案和解析)
2、已知Q与R的摩尔质量之比为9:22。在反应X + 2Y = 2Q + R中,当1.6gX与Y完全反应后,生成4.4gR,则参与反应的Y和生成物Q的质量比为( )
A.16:9 B.32:9 C.23:9 D.46:9
1、保护环境是每一个公民的责任,下列做法:① 推广使用无磷洗涤剂;② 城市生活垃圾分类处理;③推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。其中有利于保护环境的是( )
A.①②④⑤ B.②③④⑥
C.①②④⑥ D.③④⑤⑥
27.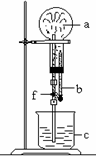 (10分)资料:氨(NH3)是一种没有颜色,有刺激性气味的气体,极易溶解于水且溶解得很快,在常温下,1体积水大约可溶解700体积氨气。氨的水溶液叫做氨水。氨水有弱碱性,能使酚酞溶液变红或使湿润的红色石蕊试纸变蓝。
(10分)资料:氨(NH3)是一种没有颜色,有刺激性气味的气体,极易溶解于水且溶解得很快,在常温下,1体积水大约可溶解700体积氨气。氨的水溶液叫做氨水。氨水有弱碱性,能使酚酞溶液变红或使湿润的红色石蕊试纸变蓝。
请依据上述资料中提供的相关信息完成本题。
某同学通过以下实验探究喷泉实验的原理。
(1)按图示装置进行氨的喷泉实验。(图中a为充满氨气的圆底
烧瓶;b为固定在橡皮塞上内装有少量水的滴管;c为酚酞溶液;
f为止水夹,该止水夹夹在连接有上下两段玻璃管的胶管上,上段
玻璃管固定在橡皮塞上且伸入烧瓶内,下段玻璃管伸进酚酞溶液中)
请说明应如何引发喷泉。
。
(2)该同学做实验时,发现烧杯中只有少量液体通过玻璃管缓缓进入烧瓶,并未形成喷泉,请分析导致实验失败的可能原因。(可不填满,也可补充)
①
②
③
(3)该同学依据上述喷泉实验的原理,更换了实验药品,在上图装置中的烧瓶中充满干燥气体a ,滴管中装有液体b ,按上述操作引发喷泉,烧杯中的液体c最终几乎充满烧瓶(b和c相同)。则a和b分别是 (填写相应的序号)。
|
|
a(干燥气体) |
b或c(液体) |
|
① |
空气 |
水 |
|
② |
CO2 |
4mol/LNaOH溶液 |
|
③ |
Cl2 |
饱和NaCl溶液 |
|
④ |
NH3 |
1mol/LHCl溶液 |
26.(6分)取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:[第(3)问请写出计算过程]
(1)原混合液中Na2SO4的物质的量浓度为________ __ mol ·L-1;
(2)产生的气体在标准状况下的体积为_______ __L;
(3)过滤出沉淀后,计算所得滤液的物质的量浓度(设反应前后溶液的密度均为
1g·cm-3,反应前后溶液体积变化忽略不计)。
25.(6分)用KMnO4与足量浓度为12mol/L的浓盐酸反应.反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
回答下列问题:
(1) 15.8g KMnO4能氧化的HCl物质的量为多少?
(2) 产生的Cl 2在标准状况下的体积为多少?
24.(6分)已知某纯碱(Na2CO3)试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
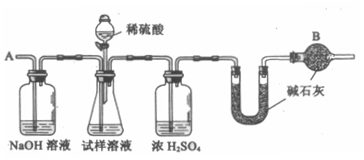
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将a g试样放人锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的U型管的质量,得到b g;
④从分液漏斗滴人6 mol·L-1 的硫酸,直到不再产生气体时为止;
⑤从导管A处缓缓鼓人一定量的空气;
⑥再次称量盛有碱石灰的U型管的质量,得到c g;
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g;
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果将 (填偏高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
23.(6分)海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里欲从海带中提取碘。(已知Cl2 + 2KI = 2KCl + I2)
(1)指出提取碘的过程中有关的实验操作名称:①___________;②___________
(2)提取碘的过程中可供选择的有机溶剂是( )
A.苯、酒精 B.CCl4、苯 C.汽油、乙酸
(3)为使海带灰中的碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,仍缺少的玻璃仪器是__________。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏过程(为防止碘升华,本实验中采用水浴加热)。指出下图所示的蒸馏装置中的错误:
①_________________________________,
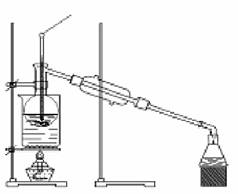 ②____________________________ __
②____________________________ __
22.(6分)已知反应:2H2CrO4 + 3H2O2 = 2Cr(OH)3 + 3O2 ↑+ 2H2O 该反应中H2O2只发生如下变化过程:H2O2→O2
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是 →
(3)在反应方程式中标明电子转移的方向和数目(单线桥)
(4)如反应中转移了0.3mol电子,则产生的气体在标准状况下体积为
21.(4分)自然界中的物质多数是以混合物的形式存在,下面是混合物的分离和提纯要求,请填空:
(1)除去KNO3固体中混有的少量NaCl,所进行的实验操作依次为:_________、加热、冷却、结晶、_________。
(2)除去KCl溶液中的SO42-离子,须依次加入的溶液为(填溶质的化学式):
20.(8分)以不同的分类标准,可以把某些物质分入不同的类别进行研究,是化学研究中的一种常用的重要方法。如氯化氢这种物质在不同的分类标准下可以分别划入气体、无氧酸、易溶物、氯化物、氢化物、电解质等若干类物质中。
现有氢氧化钠、氧气、氧化铜、盐酸四种物质,请设计出4种分类标准,使其得到这样的分类结果:其中一种物质单独属于一类,其余三种物质均不属于这一类,将结果填人下表中:
|
序号 |
分类标准 |
单独属于一类的物质名称 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com