
题目列表(包括答案和解析)
22、下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
①一般认为1:1的硫酸浓度大于60%,就具有一定的氧化性, 越浓氧化性越强,60%以下的H2SO4氧化性就不怎么强了。
②温度也影响氧化性,如铜放于冷的浓硫酸中反应不明显,如果加热就可以观察到明显现象。
③98%的浓硫酸物质的量浓度为18.4mol·L-1,密度为1.84g·cm-3
据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓硫酸10-15滴(约0.5mL),加热至沸腾,该试管中液体是否有有明显变化______ _____。试用数据解释原因_______________________________________________。
(2)甲同学再用分液漏斗加浓硫酸10mL再加热至沸腾,现象是
____________________________________________________。
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应。所观察到与甲不同的现象是 __________________原因是__________________________________。为了最终看到与甲类似的现象,乙同学需进行的操作是___________________。
(4)乙同学进行加热,还在带支管的试管中观察到有黑色物质出现,大胆假设此物质是_______________。
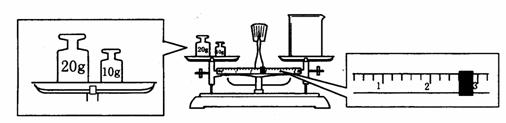
21、(1)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,题右图是该同学转移溶液的示意图,图中的两个错误是:___________________________________________________;___________________________________________________。
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为___________g.
(3)指出下面3个实验中各存在的一个错误:
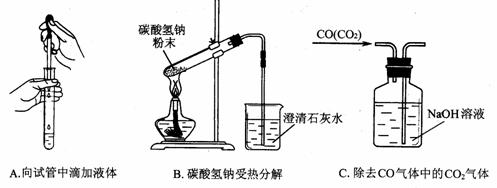
A__________________________,B__________________________,
C___________________________

20、过渡元素高价化合物在酸性条件下有较强的氧化性,如KMnO4、Na2WO4(钨酸钠)等,钨的最高价为+6价。现有钨酸钠晶体(Na2WO4·2H2O)0.990g加水溶解后,再加入一定量的锌和稀H2SO4,反应生成一种蓝色化合物(可看作含+5价、+6价混合价态的钨的氧化物)且无H2产生。现用0.044mol/L KMnO4酸性溶液滴定这种蓝色化合物恰好将其氧化为一种黄色化合物,KMnO4中的+7价锰被还原成Mn2+,共耗去KMnO4酸性溶液8.20mL(已知在酸性条件下氧化性:KMnO4>+6价的W的化合物)。上述蓝色化合物是
A.W10O21 B.W8O22 C.W10O27 D.W5O14
 第Ⅱ卷(共80分)
第Ⅱ卷(共80分)
19、
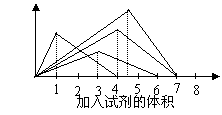 右图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应的曲线变化关系的实验项
右图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应的曲线变化关系的实验项
A.往Ba(OH)2溶液中逐滴加入磷酸溶液
B.往澄清石灰水中逐渐通入CO2气体
C.往AlCl3溶液中逐NaOH溶液
D.往NaAlO2溶液中逐滴加入盐酸溶液
18、对于某酸性溶液(可能含有Br –、SO42 –、H2SO3、NH4+),分别进行如下实验:
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。
对于下列物质不能确定其在原溶液中是否存在的是 ( )
A.Br – B.SO42– C.H2SO3 D.NH4+
17、下列反应,最终有沉淀生成的是
A.向石灰水中通入过量的CO2
B.向NaCl饱和溶液中通入氨气及过量的CO2
C.向氯化钙溶液中通入过量的CO2
D.向硅酸钠溶液中通入过量的CO2
16、下列各组中的两种溶液,不用其它试剂就可以鉴别开的是
①H3PO4,Ba(OH)2 ②FeCl3,NaOH ③NaOH,AlCl3 ④NaAlO2,HCl ⑤AgNO3,氨水
A.全部 B. ②③④ C. ②③ D. ③④⑤
15、“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐 ”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是
A.CaOCl2 B.(NH4)2Fe(SO4)2 C.BiONO3 D.K3[Fe(CN)6]
14、下列除去杂质的实验方法正确的是 ( )
A.除去CO中少量O2:通过灼热的Cu网后收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
D.除去CO2中的少量HCl:通入饱和NaHCO3溶液,收集气体
13、下列离子方程式正确的是 ( )
A.向NaHSO4溶液中滴加Ba(OH)2溶液恰好到中性
H+ + SO42- + Ba2+ + OH- = BaSO4↓+ H2O
B.用NaOH溶液吸收少量H2S气体,
OH- + H2S = HS- + H2O
C.漂白粉溶液中通入适量的SO2气体
Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓+2HClO
D.向NaHCO3溶液中加入少量Ca(OH)2溶液
2HCO3- + Ca2+ + 2OH- = CaCO3↓+ CO32- + 2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com