
题目列表(包括答案和解析)
6、同温同压下,某空瓶充满N2时重114g,充满CO2时重122g,充满某气体时重116g,则某气体的相对分子质量是( )
A、44 B、28
C、60 D、32
5、在2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O反应中,还原剂和氧化剂的物质的量之比是( )
A、1:5 B、5:1
C、1:8 D、8:1
4、20℃时,NaCl的溶解度是36g,此时NaCl饱和溶液的密度是1.12g/ cm3,此时NaCl饱和溶液中NaCl的物质的量浓度为( )
A、1.36mol/ L B、5.07mol/ L
C、6.15mol/ L D、0.15g/mol
3、50mlH2SO4的质量分数为35%、密度为1.24g/cm3的硫酸中,硫酸的物质的量浓度为( )
A、44mol/ L B、4.4mol/ L
C、0.44mol/ L D、0.044 mol/ L
2、在标准状况下,测得1.92g某气体的体积为672ml,此气体的摩尔质量是( )
A、64 B、64g
C、128g/mol D、64g/mol
1、71gNa2SO4中含有Na+的物质的量是( )
A、0.25mol B、0.5mol
C、1mol D、2mol
22. (6分)将5.0 LNaCl溶液和3.0 LBaCl2溶液混和,设混和后总体积为8.0 L,并测得NaCl物质的量浓度为0.50 mol·L-1,BaCl2物质的量浓度为0.30 mol·L-1。问:
(1)混合溶液中则Cl- 物质的量浓度为多少?(2分)
(2)混和前NaCl溶液中NaCl的物质的量浓度为多少?(2分)
(3)混和前BaCl2溶液中BaCl2的物质的量浓度为多少?(2分)
21. 工业品纯碱中常含有少量的NaCl等杂质,图2-12中的仪器装置可用来测定纯碱中Na2CO3的质量分数,图中标号:①空气;②某溶液 ③纯碱样品,④稀H2SO4,⑤浓H2SO4,⑥碱石灰(碱性干燥剂),⑦碱石灰。
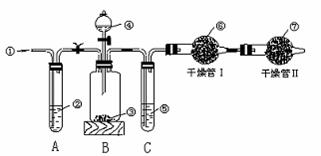
实验步骤是:
①检查装置的气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1 g)。
③准确称量一定量的纯碱的质量(设为m2 g),并将其放入广口瓶中;
④从分液漏斗中缓缓滴入稀H2SO4,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为m3 g)。
根据上述实验,回答下列问题:
(1)鼓入空气的目的是 。
(2)装置A中液体②应为 (用化学式),若撤去装置A,直接向装置B中缓缓鼓入空气,测定结果将 (填“偏大”“偏小”或“不变”)。
(3)装置C的作用是 ,如果撤去装置C,则会导致实验结果 (填“偏大”“偏小”或“不变”)。
(4)干燥管Ⅱ的作用是 。
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是: ,如果这两步操作太快,则会导致实验测定结果 (填“偏大”“偏小”或“不变”)。
四 计算题
20、(10分)某混合物A由NaCl和BaCl2组成,为将其分离,某同学设计如下流程操作图:
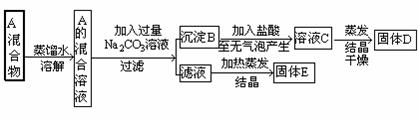
据此回答下列问题:
(1)用化学式写出物质B 、D、E的组成B 、D 、E ;
(2)要从E中提纯NaCl,应采用的方法是 。
反应的离子方程式为 。
三 实验题(16分)
19.(8分)有两种白色粉末A.B,进行如下实验:
(1)加水时,A能溶于水而B不溶于水。
(2)加热至250℃,A能分解而B不能分解。
(3)焰色反应,A呈现紫色而B无此现象。
(4)取相同质量的A.B分别与足量盐酸反应,在相同条件下能生成相同质量的气体,且气体均为无色略带酸味,能使澄清石灰水变浑浊。
试判断A.B各为何物质,写出A.B与盐酸反应的离子方程式:
A ,B ;(用化学式填写)
A+盐酸 ;
B+盐酸 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com