
题目列表(包括答案和解析)
13.下列有关Na2CO3和NaHCO3性质的比较中,正确的是 ( )
A.等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3
B.热稳定性Na2CO3<NaHCO3
C.常温时水溶性Na2CO3<NaHCO3
D.相对分子质量Na2CO3<NaHCO3
12.配制100 mL 1.0 mol/LNa2C03溶液,下列操作正确的是 ( )
A.称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒人容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
11.下列反应的离子方程式书写正确的是( )
A. 氢氧化镁与稀硫酸反应 H+ + OH- = H2O
B. 钠与水的反应 Na + 2H2O = Na+ + 2OH- + H2↑
C. 碳酸钙溶于醋酸CaCO3 + 2H+ Ca2+ + CO2↑ + H2O
D. 用氢氧化钠溶液吸收少量二氧化碳2OH-+CO2=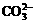 +H2O
+H2O
10.氯化镁溶液的密度为1.18g•cm-1 ,其中镁离子的质量分数为5.1%。300mL该溶液中Cl-离子的物质的量约等于( )
A. 0.37mol B. 0.63mol C. 0.74mol D. 1.5mol
9.在某溶液中酚酞呈粉红色。下列离子在该溶液中不能大量存在的是( )
A. K+ B. Na+ C. Ba2+ D. Al3+
8.实验室制Cl2的反应为4HCl(浓)十Mn02  MnCl2+C12↑+2H2O.下列说法错误的是( )
MnCl2+C12↑+2H2O.下列说法错误的是( )
A.还原剂是HCl,氧化剂是Mn02
B.每生成1 molCl2,转移电子的物质的量为2 mol
C.每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
7.在无色透明的酸性溶液中能够大量共存的一组离子是( )
A.NH4+、Al3+、SO42-、 NO3- B.K+、Na+、NO3-、SO32-
C.K+、 MnO4-、NH4+、NO3- D.Na+、K+、HCO3-、NO3-
6.设NA代表阿伏加德罗常数,下列说法正确的是( )
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.常温常压下,11.2L甲烷中含有的氢原子数为2NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
5.在标准状况下,将2.00 g氦气、1.40 g氮气和1.60 g氧气混合,该混合气体的体积是( )
A. 6.72 L B. 7.84 L C.10.08 L D.13.44 L
4.已知Q与R的摩尔质量之比为9:22。在反应X + 2Y = 2Q + R中,当1.6gX与Y完全反应后,生成4.4gR,则参与反应的Y和生成物Q的质量比为( )
A.16:9 B.32:9 C.23:9 D.46:9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com