
题目列表(包括答案和解析)
23.(10分)卤素互化物是指不同卤素原子之间通过共用电子对形成的化合物,其通式为XYn(n=1、3、5、7,且非金属性:X<Y)。卤素互化物大多为强氧化剂。试回答下列问题:
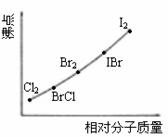 (1)若n=7,则最有可能生成卤素互化物应是_______________(写分子式)。
(1)若n=7,则最有可能生成卤素互化物应是_______________(写分子式)。
(2) XY型卤素互化物与卤素单质结构相似。依据右图,推测ICl的沸点所处的最小范围为
_____________________________。
(3)某卤素互化物与水的反应为:ClFn+H2O → HClO3 +Cl2↑+O2 ↑+HF,若ClFn与H2O 的物质的量之比为3∶5,则n=___________。
(4)现将18.65 g XYn溶于水,再通入过量SO2,生成HX、HY、H2SO4等三种酸,然后向该混合酸溶液中加入过量Ba(NO3)2 溶液后,过滤,最后向滤液中加入过量的AgNO3 溶液,结果生成61.85 g 沉淀,且溶液中除NO3- 外,无其它酸根离子。则混合酸溶液中HX与HY 两种酸的物质的量之和为_____________mol,该卤素互化物的化学式为___________________。
22.(10分)已知A、B、C、D、E、F六种短周期元素原子序数依次增大。A、B、C三种元素位于同一周期,且其中A原子基态时电子排布式为1s22s22p2;A、C原子最外层具有相同数目的未成对电子;D是所在周期中电负性最小的元素,D、E两种元素的电离能数据(单位:kJ/mol)如右表;C、F两种元素原子核内的质子数与中子数相等,形成FC2型化合物,其中C与F的质量比为1∶1。
回答下列问题:
(1) AC2是大气中的温室气体,写出AC2分子的结构式_____________________。
(2) 依据VSEPR模型预测B的氢化物的立体结构为 ,中心原子B的轨道杂化类型为 。
(3) E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的化学方程式是 。
(4) F元素有两种含氧酸,其中酸性比较强的是______________,该酸酸性强于另一种含氧酸的原因是__________________________________________________________。
21.(8分)下列物质:HCl、HF、H2O、NH3、CO2、CaO、Na2O2、H2、Br2、NaF、CH4、CCl4、MgCl2、NH4Cl。
(1)上述物质中,含有非极性共价键的是_____________;属于非极性分子的化合物是_____________________。
(2) Br2(液溴)在CCl4 中的溶解度比在水中大的原因是
______________________________。
(3) N、O、F三种元素的原子形成 NH3、H2O、HF微观过程说明,氢化物分子中H原子数与其对应的基态原子中的未成对电子数有关,则你对基态C原子形成CH4分子的微观过程的合理猜想是__________________________________________________。
|
|
I1 |
I2 |
I3 |
I4 |
|
D |
500 |
4600 |
6900 |
9500 |
|
E |
580 |
1800 |
2700 |
11600 |
20.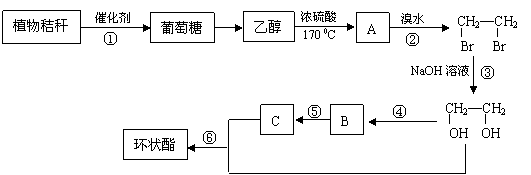 (8分) 随着现代工业的发展,能源问题已经越来越引起人们的重视。农民焚烧植物秸秆(主要成分是纤维素),不仅污染环境,也是资源的浪费。工业上利用植物秸秆为原料合成有机物环状酯。
(8分) 随着现代工业的发展,能源问题已经越来越引起人们的重视。农民焚烧植物秸秆(主要成分是纤维素),不仅污染环境,也是资源的浪费。工业上利用植物秸秆为原料合成有机物环状酯。
(1)在反应①-⑥中,属于取代反应的是___________________(填序号)。
(2) 反应①和②的化学方程式分别为
①____________________________________;②_______________________________。
(3)环状酯的化学式为C4H4O4,其结构简式为_______________________。
19.(6分) 已知有关物质的熔沸点数据如下表:
|
|
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
熔点/℃ |
2852 |
2072 |
714 |
190(2.5×105Pa) |
|
沸点/℃ |
3600 |
2982 |
1412 |
182.7 |
(1) 工业上常用电解熔融MgCl2的方法生产金属镁,而不用电解MgO的方法生产镁的原因是________________________________________________________。
(2) 电解Al2O3和冰晶石(Na3AlF6)熔融混合物的方法生产铝,该反应的化学方程式为
__________________________________,你认为冰晶石的作用是_________________。
(3) 钛(Ti)因具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强酸反应。在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛,从所得的产物中获取金属钛的方法是_____________________________________。
18. (10分)实验室可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请你参与研究:
(10分)实验室可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请你参与研究:
(1)实验时,试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入操作顺序是___________________________
___________________ 。
(2)试管a中发生反应的化学方程式为
________________________________________________。
(3)试管b中加有饱和Na2CO3溶液 ,其目的是
________________________________________________________________。
(4)若分离试管b中的混合物,需要用到的玻璃仪器是__________________。
(5)酯化反应进行得比较缓慢,用于提高该反应速率的主要措施是__________________________________________。
17.(10分)
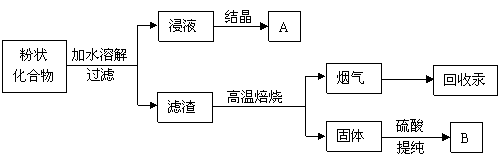 锌锰干电池广泛应用于生活、生产和科研。扔弃废干电池,不但造成资源浪费,还可造成严重环境污染。综合利用废干电池,除回收金属和碳棒外,对其内部的粉状化合物的处理过程如下:
锌锰干电池广泛应用于生活、生产和科研。扔弃废干电池,不但造成资源浪费,还可造成严重环境污染。综合利用废干电池,除回收金属和碳棒外,对其内部的粉状化合物的处理过程如下:
试回答下列问题:
(1)锌锰干电池在使用过程中,负极发生的电极反应为__________________________。
(2)锌锰干电池内粉状化合物主要为MnO2 和NH4Cl糊。回收时得到的产品A的主要成分是_________、___________(填化学式),将其分离的方法是__________________。
(3)回收得到的产品B是MnSO4,在生产过程中一般需将其转化为重要的化工原料MnCO3。按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,你认为将MnSO4转化为MnCO3选用的反应物是_______________,得到的另一种最终产物的用途是_____________________________。
16.已知1mol N2和1molO2反应生成2 mol NO需要吸收180 kJ热量,其中N≡N、O=O键的键能分别为946 kJ·mol-1、498 kJ·mol-1,则N=O键的键能为
A.1264 kJ·mol-1 B.632 kJ·mol-1
C.316 kJ·mol-1 D.1624 kJ·mol-1
第Ⅱ卷(非选择题 共72分)
15.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:
2A(气) + B(气) 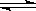 2C(气) 。
2C(气) 。
若经2 s后测得C的浓度为0.6 mol•L-1。下列说法正确的是
A.用物质A表示的反应的平均速率为0.3 mol•L-1•s-1
B.用物质B表示的反应的平均速率为0.6 mol•L-1•s-1
C.2s时物质A的转化率为70%
D.2s时物质B的浓度为0.7 mol•L-1
14.现有下列四个小实验,简要实验步骤及现象如下:①在紫色的KMnO4酸性稀溶液中,逐滴滴入过氧化氢溶液,溶液温度变化不大,但褪色速率越来越快;②将化学荧光棒[外层是塑料管放草酸二苯酯(还原剂)及发光颜料,内玻璃管中放入4%过氧化氢溶液]弯曲,内管断裂,液体混合,发出五颜六色的光;③两根外形相同的铁棒和锡棒紧靠,放入稀硫酸中,发现一根棒的表面有气泡产生;④正在烧煤球的煤炉中,滴上几滴水,立刻串出火苗。
下列分析正确的是
A.实验①中,反应生成的Mn2+可能是该反应的催化剂
B.实验②中,该反应是化学能转变为光能
C.实验③中,有气泡产生的棒是铁棒
D.实验④中,加入的水是反应的催化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com