
题目列表(包括答案和解析)
1.下列反应既属于氧化还原反应,又属于吸热反应的是
A.镁条与稀硫酸反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.天然气燃烧
24. (8分)某元素的同位素x zX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;
(3)把X的单质放入水中,有何现象?写出反应的化学方程式。
23.(13分)下表是元素周期表的一部分, 针对表中的①-⑨种元素,填写下列空白:
|
主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
|
2 |
|
|
|
① |
② |
③ |
|
|
|
3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
|
|
(1) 在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______________,碱性最强的化合物的电子式是:____________________________________;
(3) 用电子式表示元素⑦的单质分子的形成过程:________________________________
;
(4) 用电子式表示元素④与⑥的化合物的形成过程:_____________________________
,该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式 ,该化合物含的共价键类型是
(6)由③和④按原子个数比1:1形成的化合物的电子式是 该化合物含的化学键类型是
22. (6分)A、B、C、D四种短周期元素,原子序数
(6分)A、B、C、D四种短周期元素,原子序数
D>A>B>C,且A、B同周期,C、D同主族,A的
原子结构示意图如右上图,B、C可形成离子化合物B3C2,
据此填空:
(1)A的元素名称为 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子半径由小到大的顺序为
(3)B和C最高价氧化物的水化物化学式分别为 和 。
21.(5分)有A、B、C、D、E五种微粒,其组成均有氢元素,且电子总数为10个,A是双原子的阴离子,它们之间能发生下列变化:
 (1)A+B
(1)A+B C+D↑ (2)C+ C A+E
(3)D+E
C+D↑ (2)C+ C A+E
(3)D+E B+C
B+C
由此可知它们的化学式分别为:
A ,B ,
C ,D ,
E 。
20.(12分)动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
|
实验步骤 |
实验现象 |
|
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
|
②向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
|
③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
|
④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
|
⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
|
⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③ ,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
|
实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
实验现象(填A~F) |
|
|
|
|
|
|
① ,② ,
(4)实验结论: ,
19.(10分)某课外兴趣小组欲探究铝与盐酸的反应实验中反应速率与哪些因素有关。请填写下列空白:
(1)实验反应原理: 。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、胶头滴管、温度计;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
(3)实验装置 (图中铁架台等夹持仪器略去)
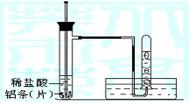
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性,具体操作方法是:
。
②取3块铝条加入到试管中,操作方法是
。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。
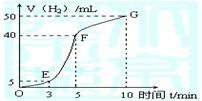
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG表示),并解释原因
速率大小比较: 。原因:____________________________
18.短周期元素A、B、C, 原子序数依次递增,它们原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述正确的是 ( )
A.元素的金属性A<B<C B.A的氢化物的稳定性大于C的氢化物
C.B的最高价氧化物的对应水化物呈碱性D.A与C可形成离子化合物
第Ⅱ卷 (非选择题 共54分)
17.两种微粒的质子数和电子数均分别相等,它们不可能是 ( )
A.一种阳离子和一种阴离子 B.一种单质和一种化合物分子
C.一种分子和一种离子 D.一种原子和一种分子
16.短周期的三种元素X、Y、Z,已知X元素的原子最外层只有一个电子,Y元素的原子M层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L层上的电子数比Y元素原子的L层上的电子数少2个,则这三种元素所组成的化合物的化学式不可能的是 ( )
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com