
题目列表(包括答案和解析)
6、有一包白色固体,可能是CaCl2、K2CO3和Ba﹙NO3﹚2的混合物,也可能是其中的一种。将此白色固体溶解于水中时,有白色沉淀生成,将部分沉淀转移入试管中,加入稀盐酸,有气体生成。取上一步的溶液少量滴入稀硫酸中,有白色沉淀生成。另外取上一步的溶液少量滴入AgNO3溶液,有白色沉淀生成,在加入稀硝酸,沉淀不溶解。通过上述实验现象分析,该白色固体中一定含有的物质是( )
A.K2CO3、Ba﹙NO3﹚2 B. CaCl2、K2CO3、Ba﹙NO3﹚2
C.CaCl2、K2CO3 D.CaCl2、Ba﹙NO3﹚2
5、已知Cl元素的最低化合价是–1价,最高化合价是+7价,那么根据下列物质中Cl元素的化合价判断,下列说法中错误的是( )
A.NaCl具有还原性 B.KClO3具有还原性
C.NaClO既有氧化性,又有还原性 D.HClO4具有还原性
4、已知在加热条件下,KHCO3可以分解成K2CO3,H2O和CO2。现将50g KHCO3和K2CO3的混合物加热到质量不再变化时,生成6.6g CO2,此混合物中KHCO3的质量分数是( )
A.75.7% B.60% C.50% D.40%
3、在化学上,常用CaH2作为制取氢气的药剂,有关的化学方程式为:CaH2+2H2O=
Ca﹙OH﹚2+ 2H2↑。在这个反应中,H2O( )
A.是还原剂 B.是氧化剂
C.是溶剂 D.既不是氧化剂,又不是还原剂
2、下列离子方程式中,书写正确的是( )
A.稀硫酸滴到铁片上:Fe + H+= Fe2++ H2↑
B.硫酸滴到碳酸钾上:CO32-+ 2H+= H2CO3
C.碳酸氢钠溶液与盐酸混合:HCO3-+ H+= CO2↑+ H2O
D.硫酸铜溶液与氢氧化钠溶液混合:CuSO4 + 2 OH-= Cu﹙OH﹚2↓+ SO42-
1、下列各组中的离子,能在溶液中大量共存的是( )
A.K+、H+、SO42-、OH- B.Na+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32- D.Na+、Cu2+、Cl-、SO42-
18.(6分)氨气极易溶于水,人们把氨气溶于水得到的溶液称为氨水。将标准状况下11.2 L氨气溶于100 mL水中,得到密度为0.860g·cm-3的氨水。求所得氨水的物质的量浓度.
17.(6分)某盐酸的密度为1.095g/cm3,其质量分数10.0%,试计算:
(1)该盐酸的物质的量浓度;
(2)200 mL的该盐酸与过量的锌粉充分反应,产生的氢气体积(标准状况);
(3)生成ZnCl2溶液中溶质的物质的量浓度(假设溶液体积不变)。
16.(每空2分,共26分。)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放一团脱脂棉。
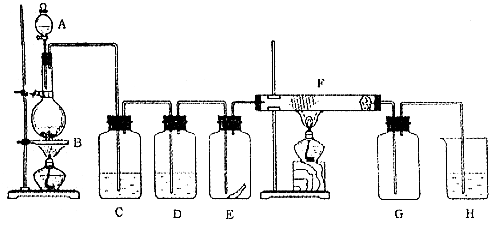
试回答:
(1)做实验之前,应该先 ;如何操作: ;
(2)A中所放试剂为_______________,B中所放试剂为_____________,二者反应的离子方程式为_________________________;
(3)C中试剂是______ ____;D中试剂的作用是_____________ ;
(4)E中现象是_________ _; F中现象是____ ____,其反应的化学方程式为_____ __;
(5)H中试剂为___________,反应的离子方程式为________ ____ ___;
(6)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是__________ ___。
15.(6分)在配制一定物质的量浓度的硫酸溶液时,出现下列情况时溶液的物质的量浓度有何影响(选A、B、C填空:A---偏高、B---偏低、C---无影响)。
(1)用量筒量取浓硫酸时俯视刻度线___________;
(2)摇匀后发现凹液面下降,又加蒸馏水至刻度线__________;
(3)配制前容量瓶用水洗涤后未进行干燥处理__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com