
题目列表(包括答案和解析)
40.某石灰厂利用本地资源石灰石(所含杂质高温不分解,也不跟酸反应),在石灰窑内高温煅烧生产生石灰。取煅烧后的样品5.92 g,跟25.0 mL盐酸恰好完全反应,放出二氧化碳44.8 mL(标准状况),滤出残渣0.12 g。请计算:
(1)石灰石中碳酸钙的转化率(分解率)。
(2)盐酸的物质的量浓度。
解析:(1)n(CO2)=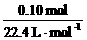 =0.002 mol,故已反应的CaCO3为0.002
mol。样品中生石灰的质量为:5.92 g-0.12 g-0.002 mol×100 g·mol-1=5.60
g,n(CaO)=0.10 mol
=0.002 mol,故已反应的CaCO3为0.002
mol。样品中生石灰的质量为:5.92 g-0.12 g-0.002 mol×100 g·mol-1=5.60
g,n(CaO)=0.10 mol
CaCO3的转化率为: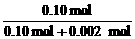 ×100%=98%
×100%=98%
(2)CaCO3 + 2HCl====CaCl2+H2O+CO2↑
39.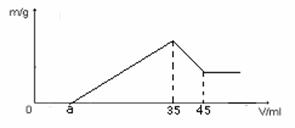 准确称量6g铝士矿样品(含Al2O3 、Fe2O3 、SiO2 )放入盛100 mL某浓度的硫酸溶液烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1NaOH
溶液,产生的沉淀的质量m 与加入NaOH 溶液的体积V关系如下图:
准确称量6g铝士矿样品(含Al2O3 、Fe2O3 、SiO2 )放入盛100 mL某浓度的硫酸溶液烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1NaOH
溶液,产生的沉淀的质量m 与加入NaOH 溶液的体积V关系如下图:
⑴ 求H2SO4 溶液的物质的量浓度是多少?
⑵ 若a=2.3mL时,则铝土矿中各组成成分
的质量分数是多少?
⑶ a值的范围在 之间,
在这个范围中a值越大 含
量越小。
解:⑴ c(H2SO4)== 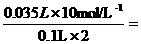 1.75 mol·L-1
1.75 mol·L-1
⑵ 据 Al(OH)3+OH―= AlO2―+2H2O ; n(OH―)= (45mL-35mL)×10-3×10 mol/L=0.1mol
1mol 1mol
n 0.1mol n(Al2O3) = n(Al(OH)3) /2=0.1mol/2=0.05mol
m(Al2O3)
= 0.05mol×102g/mol = 5.1g ω(Al2O3)= 
据 n [Fe(OH)3
Al(OH)3 ] == 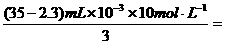 0.109mol
0.109mol
n (Fe2O3, Al2O3)=0.109mol/2=0.0545mol
n (Fe2O3)=0.0545mol-0.05mol=0.0045mol
m (Fe2O3)=0.0045mol×160g/mol=0.72g
ω(Fe2O3)=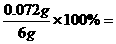 12%
12%

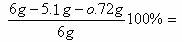
ω(SiO2) =
⑶铝土矿总质量为6g,从图中可知其中Al2O3 为一定值,Fe2O3 和 SiO2 的各自含量不定,,由Fe2O3 的量决定a的值,所以,当Fe2O3 的量为 0g 时,沉淀只是Al(OH)3
a值为:35mL-(0.1 mol×3/10 mol·L-1 )== 35mL -0.03L== 35mL -30mL == 5 mL 。当Fe2O3 的量为 0.9g 时,沉淀只是Fe(OH)3和Al(OH)3,
n(Fe2O3)=
n (Fe(OH)3)=0.005625mol×2=0.01125mol
a值为:35mL - (0.01125 mol×3 /10 mol·L-1 ×1000+ 30mL)
== 35mL-33.375mL
==1.625 mL
答案:⑴1.75 mol·L-1 ⑵ω(Al2O3)= 85% ω(Fe2O3)= 12% ω(SiO2)= 3%
⑶ a值在1.625 mL与5mL之间;a值越大Fe2O3含量越小。
38. 实验室也可用KMnO4固体和浓盐酸反应制氯气,反应方程式如下:
2KMnO4+16HCl(浓) 2KCl+2MnCl2+8H2O+5Cl2。
2KCl+2MnCl2+8H2O+5Cl2。
完成下列问题:
(1)该反应中氧化剂是_____________,还原产物是__________________。
(2)若反应中有0.5 mol电子转移,被氧化的HCl的物质的量是多少?参加反应的高锰酸钾质量为多少?
答案:(1)KMnO4 MnCl2
(2)被氧化的的HCl的物质的量有0.5mol,有15.8g KMnO4参加了反应。
37.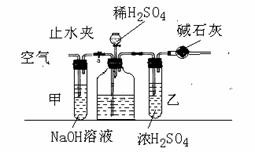 工业生产的纯碱中常含有少量的NaCl等杂质。下图是测定产品中碳酸钠质量分数的实验装置。实验步骤有:
工业生产的纯碱中常含有少量的NaCl等杂质。下图是测定产品中碳酸钠质量分数的实验装置。实验步骤有:
A.在干管中填满碱石灰,质量为mg;
B.取ng样品装入广口瓶中; C.检验装置的气密性;
D.缓缓鼓入空气数分钟,再称干燥管质量为wg;
E.关闭止水夹; F.打开止水夹;
G.缓缓加入稀硫酸到不再产生气体为止;
H.缓缓鼓入空气数分钟。
 ⑴正确操作顺序是(填写符号)
⑴正确操作顺序是(填写符号)
C F E G D
 ⑵操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是
;装置甲的作用是
;
⑵操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是
;装置甲的作用是
;
⑶溶液中碳酸钠的质量分数的计算式为: ;
⑷若去掉装置甲,测定结果为 ;若去掉装置乙,测定结果为 ;(填“偏大”、“偏小”、或“无影响”)
答案:⑴BHAF ⑵使CO2全部排出;吸收空气中CO2 ⑶53(w-m)/22n ⑷偏大;偏大。
36.(10分)在盛有NaI、AgNO3、CaCl2、K2CO3、HBr的已失去标签的五种无色溶液的试剂瓶上,分别贴上①②③④⑤的编号,使它们两两反应,产生的现象在下表中列出。请在表中的结论格内,填写这些编号所代表的物质的名称。
|
|
① |
② |
③ |
④ |
⑤ |
|
① |
-- |
无色↑ |
白色↓ |
白色↓ |
无 |
|
② |
无色↑ |
-- |
无 |
浅黄↓ |
无 |
|
③ |
白色↓ |
无 |
-- |
白色↓ |
无 |
|
④ |
白色↓ |
浅黄↓ |
白色↓ |
-- |
黄色↓ |
|
⑤ |
无 |
无 |
无 |
黄色↓ |
-- |
|
结论 |
|
|
|
|
|
答案:①-⑤分别为K2CO3、HBr、CaCl2、AgNO3、NaI。
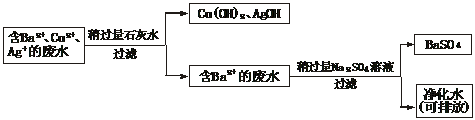
35.(8分)水污染问题是当前全世界关注的焦点问题。我们每一个人都应该自觉地保护水资源,防止污水的随意排放。化学实验过程中往往会产生污水,污水中的重金属离子如Cu2+、Ba2+、Ag+对水的污染作用很强。
某次化学实验后,回收的废液中可能含有Cu2+、Ba2+、Ag+。
(1)你认为应对该废液进行怎样的处理后才能够倒掉?
(2)写出你设计的废液处理方案及相关反应的化学方程式。
解析:(1)应该将Ba2+、Cu2+、Ag+除去后再排放。(2)对于Ba2+,可将其转化为难溶且无毒的BaSO4后过滤除去。对于Cu2+、Ag+,可以转化为Cu(OH)2、AgOH后过滤除去,还可回收。此过程中加入的试剂选石灰水而不选烧碱,因为前者价廉易得。用流程图、表格等方法描述处理方案直观简明。
答案:(1)应该将Ba2+、Cu2+、Ag+除去后再排放
(2)
34.如图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,请填写下列空白:
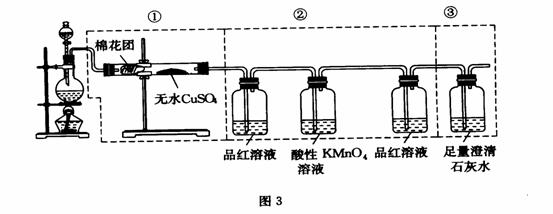
(1)若装置中①②③仪器的连接顺序改为②①③,则可以检出的物质是________;不能检出的物质是_____________。
(2)如果将仪器的连接顺序变为①③②,则可以检出的物质是______________。不能检出的物质是_________________。
(3)如果将仪器的连接顺序变为②③①,则可以检出的物质是____不能检出的物质_______
答案:(1)SO2 、CO2 、H2O (2)H2O、 CO2 、SO2(3)CO2、、、SO2、、 H20
33.请你按要求填写下表,以除去下列物质中所混有的少量杂质。
|
混 合 物 |
实验方案 |
反应化学方程式 |
|
(1)铁粉中混有少量铝粉 |
|
|
|
(2)Na2CO3固体中混有少量NaHCO3 |
|
|
|
(3)FeCl3溶液中混有少量FeCl2 |
|
|
答案:
|
混合物 |
实验方案 |
反应化学方程式 |
|
(1) |
将混合物置于烧杯中,加入足量的NaOH溶液,反应后,过滤。 |
2Al +2NaOH +2H2O
==2NaAlO2 +3H2↑ |
|
(2) |
将混合物置于适当的容器中(如:试管、蒸发皿等),加热。 |
2NaHCO3 Na2CO3
+H2O +CO2↑ Na2CO3
+H2O +CO2↑ |
|
(3) |
向该FeCl3溶液中通入适量的Cl2 |
2FeCl2+Cl2
=2FeCl3 |
32.(6分)在配制一定量的物质的量浓度溶液时,下列操作使得到的溶液浓度偏高、偏低还是不变?
(1)用量筒取液态溶质,读数时俯视量筒,所配溶液浓度_______。
(2)将取样品的药匙用水洗涤,洗涤液倒入容量瓶,所配溶液浓度_______。
(3)定容摇匀后,有少量溶液外流,所配溶液浓度_______。
解析:(1)正确的读数方法应是视线与量筒刻度线保持水平,俯视的结果使得量取的液体体积小于计算值,所以配制出的溶液浓度偏低。
(2)药匙上的药品并未称量,洗涤后转移入容量瓶,使得溶质的量增加,所配制的溶液浓度偏高。
(3)定容摇匀后,溶液的配制已经结束,从中任意取出一部分,浓度不会发生改变,所以剩余溶液的浓度不变。
答案:(1)偏低 (2)偏高 (3)不变(或无影响)
31.(1)某火力发电厂为除去有害气体SO2,并变废为宝,采用尾气脱硫新工艺,如图4-8所示。写出尾气脱硫工艺中反应的化学方程式:
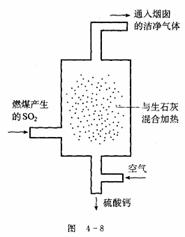 (2) 现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4•5H2O)的合理方案,用简要的文字和化学方程式说明。
(2) 现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4•5H2O)的合理方案,用简要的文字和化学方程式说明。
第一步:
第二步:
第三步:过滤,加热浓缩,冷却结晶
答案:(1)
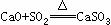
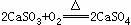
(2)第一步 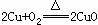 第二步
第二步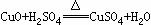
第三步 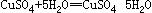
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com