
题目列表(包括答案和解析)
22、现有NaOH、Na2CO3和Ba(OH)2三种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是
A.HCl B.H2SO4 C.Na2SO4 D.CaCl2
21、镁粉在焰火、闪光灯中是不可缺少的原料,工业上制造镁粉是将镁蒸气在气体中冷却。下
列气体中,可用来冷却镁蒸气的是( )
A、空气 B、二氧化碳 C、氢气 D、氩气
24.(8分)将一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将放出的气体通入足量的Ca(OH)2饱和溶液中,充分反应后得到的沉淀的质量是1.0g,加热后剩余的固体物质与足量的稀盐酸反应,收集到2.2g气体,计算原固体混合物中Na2CO3与NaHCO3的质量。
23.(5分)200℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6 g,求原混合物中CO2和H2O的物质的量之比为 。
22.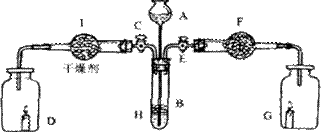 (9分)为证明有关物质的性质,某学生设计了如下图所示的装置:
(9分)为证明有关物质的性质,某学生设计了如下图所示的装置:
当关闭E打开活塞C,使液体A与搁板H上的固体B相遇时,即有气体产生,并发现D中蜡烛慢慢熄灭;关闭C打开E时,则看到G中蜡烛燃得更亮。请回答:
(1)该装置中有关仪器内盛放的物质(填名称):
A ,B ,F 。
(2)I中干燥剂可选择(填代码): ;
A、浓硫酸 B、碱石灰 C、无水氯化钙
(3)B与A中液体反应的离子方程式为 。
(4)打开E时,干燥管F中发生反应的有 个,其中主要反应的化学方程式为: 。
21.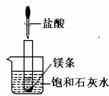 (7分)如图所示,把试管放入盛有25℃的饱和澄清石灰水中,试管中先放入几小块镁片,再用滴管滴入5
mL盐酸于试管中。试回答下列问题:
(7分)如图所示,把试管放入盛有25℃的饱和澄清石灰水中,试管中先放入几小块镁片,再用滴管滴入5
mL盐酸于试管中。试回答下列问题:
(1) 实验中观察到的现象是: ① ;
② 。
(2)产生上述现象的原因是
。
(3)写出有关反应的离子方程式: 。
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”或“小于”或“等于”)镁片和盐酸的总能量。
20、(6分)有一包白色粉末,其中可能含有Na2CO3、NaCl、K2SO4、CuCl2、BaCl2、KCl和Na2SO4,现按下列步骤进行实验:(1)将该粉末溶于水得无色溶液和白色沉淀
(2)在滤出的沉淀中加入稀HNO3后,沉淀完全溶解,同时产生无色气体
(3)取滤液做焰色反应,火焰呈黄色,隔着蓝色钴玻璃观察,火焰呈紫色。
由上述实验现象推断:混合物中一定含有 ;一定不含有 ;不能肯定是否含有 。
19.(6分)用双线桥标出下列反应的电子转移方向和数目:
(1) 2Na2S + Na2SO3 + 3H2SO4(稀)= 3S + 3Na2SO4 + 3H2O,
氧化产物与还原产物的质量之比为: 。
(2) 3BrF3 + 5H2O = 9HF + Br2 + HBrO3 + O2
氧化剂是: ;还原剂是: 。
18.(8分) 欲除去下表溶液中的杂质,写出所加试剂(适量)的化学式和有关离子方程式:
|
溶液 |
杂质 |
应加试剂 |
离子方程式 |
|
BaCl2 |
HCl |
|
|
|
Na2SO4 |
Na2CO3 |
|
|
|
KCl |
K2SO4 |
|
|
|
FeCl2 |
CuCl2 |
|
|
17.(10分)(1)(7分)碱金属原子的最外电子层都有______个电子,容易_______(填“失去”或“得到”)电子形成稳定的离子结构,表现化合价为______价;在Li、Na、K、Rb、Cs等五种元素中,随着核电荷数的增加,原子半径_____________,原子核对核外电子的引力____________,元素的原子失去电子的能力__________,氧化物的水化物碱性最强的是_____________。
(2)、(3分)现有以下物质:①氮气 ②液态CO2 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔化的KNO3 ⑨NaOH溶液, 请回答下列问题(填序号):
(1)以上物质能导电的是 ,
(2)以上物质中属于电解质的是 ,
(3)以上物质属于非电解质的是 。
(3)(3分)通常用NaHCO3悬浮液除去混在CO2气体中的少量HCl气体,其离子方程式为___________,而不用NaOH溶液的原因(用离子方程式表示)为_________________,也不用饱和Na2CO3溶液的原因(用离子方程式表示)为______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com