
题目列表(包括答案和解析)
11、C 解析:溶液中大量共存的离子必须相互不起反应。A中Mg2+和OH-能起反应生成Mg(OH)2沉淀;B中H+和CO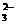 、Ca2+和CO
、Ca2+和CO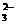 都能起反应;C中可以;D中HCO
都能起反应;C中可以;D中HCO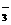 和OH-、Ca2+和OH-都能起反应。
和OH-、Ca2+和OH-都能起反应。
10、AB 解析:解本题时应采用正向思维,对每一个离子方程式进行分析。因为每一个离子方程式都应与其化学方程式及实际情况相吻合,不能随意臆造。浓硫酸与铁作用生成三价铁,而稀硫酸与铁作用则生成二价铁,故A选项不正确;Ca(HCO3)2是可溶于水的盐,应写成离子,反应前后Ca2+的数目并没有变,因此离子方程式中不应出现Ca2+,故B选项也不正确;C正确;MgCO3难溶于水,不能写成离子,D正确。
9、CD 解析:A、B不正确,因为CuCO3、BaCO3不能拆写成离子形式。C、D正确。
8、D 解析:A不正确,如SO2通入水中溶液能导电,但电解质是H2SO3。B不正确。如HCl是电解质,但液态HCl不导电,因为HCl在熔融状态下不能生成可以自由移动的离子。C错误。D是电解质的定义,故正确。
7、B 解析:A中的MnO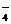 在水溶液中显紫色;C中的Cu2+在水溶液中显蓝色;D中要发生离子反应Ba2+’+SO
在水溶液中显紫色;C中的Cu2+在水溶液中显蓝色;D中要发生离子反应Ba2+’+SO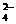
 BaSO4↓,故答案应选B,只有B符合要求。
BaSO4↓,故答案应选B,只有B符合要求。
6、D 解析:A中可发生离子反应H++OH- H2O及Mg2++2OH-
H2O及Mg2++2OH- Mg(OH)2↓;B中可以发生反应Ba2++CO
Mg(OH)2↓;B中可以发生反应Ba2++CO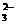
 BaCO3↓;C中可发生反应CO
BaCO3↓;C中可发生反应CO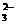 +2H+
+2H+ H2O+CO2↑;D各离子相互之间不能发生反应,故应选D。
H2O+CO2↑;D各离子相互之间不能发生反应,故应选D。
5、D解析:A中的CaCO3不能拆成离子形式;B中反应的离子方程式为:Ba2++2OH-+2H++SO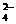
 BaSO4↓+2H2O;C的离子方程式不符合客观事实;D是正确的。
BaSO4↓+2H2O;C的离子方程式不符合客观事实;D是正确的。
4、CD解析:各选项所对应的离子方程式为:A.Ba2++2OH-+2H++SO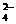
 BaSO4↓+2H2O B.Fe(OH)3+3H+
BaSO4↓+2H2O B.Fe(OH)3+3H+ Fe3++3H2O C、D:H++OH-
Fe3++3H2O C、D:H++OH- H2O
H2O
3、BC 解析:电解质是指在水溶液中或熔融状态下能够导电的化合物。题目中只有B和C是符合条件的,其中HCl在水溶液中可以导电,BaSO4在熔融状态下可以导电。NaOH溶液是混合物;CO2通入水中虽可以导电,但原因是生成了H2CO3,H2CO3是电解质。故答案应选B、C。
2、AD 解析:电解质溶液的导电能力取决于溶液中的离子浓度。离子浓度大则导电能力强。题中B、C反应后离子浓度变化不大,所以导电性变化不大,A、D中加入NaOH没有化学反应发生,但离子浓度变化较大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com