
题目列表(包括答案和解析)
17.D解析:Cu与稀硫酸不反应,在加热条件下铜和浓硫酸发生反应的化学方程式为:
Cu+2H2SO4(浓)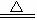 CuSO4+SO2↑十2H2O
CuSO4+SO2↑十2H2O
参加反应的H2SO4有一半被还原,在Cu与浓H2SO4的反应过程中,浓硫酸浓度逐渐降低,变成稀H2SO4时反应会停止,所以0.9molH2SO4与足量铜片反应时,被还原的H2SO4小于0.45mol。
点评:浓度不同,发生的化学反应不同,在具体分析、计算时应注意。
16.C 解析:A.Cu-4HNO3(浓)-Cu(NO3)2-2NO2
B.Cu-HNO3(稀)-Cu(NO3)2-NO
C.CuO-2HNO3-Cu(NO3)2-H2O
由以上关系式可以看出:C.既节约原料,同时又不产生有毒气体。D.成本太高亦不可采用。故C为最好的办法。
15.D解析:应用守恒法,反应中消耗的HNO3的物质的量应是转化成Cu(NO3)2和生成的NO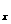 (NO和NO2)气体中N原子的物质的量之和:即
(NO和NO2)气体中N原子的物质的量之和:即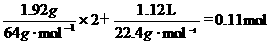 ,故答案选D。
,故答案选D。
14.C解析:铜与稀硫酸不反应,但加入KNO3后,由于溶液中有H+存在,故会发生如下反应:
3Cu+8H++2NO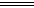 3Cu+2NO↑+4H2O。
3Cu+2NO↑+4H2O。
加入Fe2(SO4)3,也会使铜粉的质量减少,但无气体逸出,故答案选C。
13.A解析:B.王水指的是浓HNO3和浓盐酸按溶液体积之比为1:3所得的混合物。
C.硝酸与金属反应时,被还原的一般是指+5价氮,得到的还原产物是NO2、NO、N2O或N2等。
D.常温下,浓HNO3可使Fe和Al等金属发生钝化现象,故B、C、D均是错误的说法。
12.D解析:A表现了HNO3的氧化性;B表现了HNO3的酸性;C主要表现HNO3的不稳定性。
11.AC 解析:设两气体恰好完全反应,则由反应方程式:
6NO2+8NH3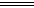 7N2+12H2O
7N2+12H2O
6 8
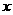
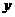
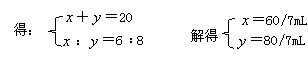
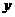 -
-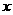 ≠2,故不可能是此种情况。
≠2,故不可能是此种情况。
①若NO2过量,NH3完全反应,设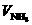 =
=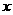 mL,则反应的NO2体积为(
mL,则反应的NO2体积为(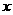 -2)mL,应有(
-2)mL,应有(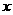 -2)∶=6∶8,解得
-2)∶=6∶8,解得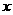 =8mL,故
=8mL,故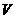 (NO2):
(NO2):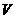 (NH3)=12:8=3:2。
(NH3)=12:8=3:2。
②若NH3过量,NO2完全反应,设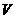 (NO2)=
(NO2)=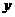 mL,则反应的NH3为(
mL,则反应的NH3为(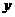 +2)mL,应有
+2)mL,应有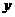 :(
:(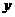 +2)=6:8,解得
+2)=6:8,解得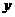 =6mL,故
=6mL,故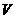 (NO2):
(NO2):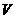 (NH3)=6∶14=3∶7
(NH3)=6∶14=3∶7
10.B解析:依题意,NH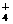 -OH--NH3↑SO
-OH--NH3↑SO -Ba2+-BaSO4↓
-Ba2+-BaSO4↓
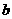 mol
mol 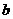 mol
mol 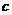 mol
mol 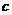 mol
mol
即混合溶液中含(NH4)2SO4为2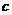 mol,其电离产生NH
mol,其电离产生NH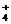 4
4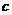 mol,则原混合溶液中NH4NO3的物质的量为(2
mol,则原混合溶液中NH4NO3的物质的量为(2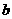 -4
-4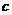 )mol,所以,
)mol,所以,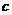 (NO
(NO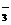 )=
)=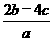 mol·L-1,答案选B。
mol·L-1,答案选B。
9.B解析:水充满烧瓶,则所得溶液的体积相同且都等于烧瓶的容积。又因为NH3和HCl的体积相同,物质的量也相同,故溶液的物质的量浓度之比为1∶l。
8.A解析:氨水的浓度为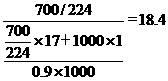 mol·L-1
mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com