
题目列表(包括答案和解析)
11.B解析:胃酸中含有少量盐酸,以上4种物质都能跟盐酸反应。但是,碳酸钠在反应后生成气体,造成“胀气”,而且碳酸钠碱性较强,对口腔和食道有刺激作用;氧化钙与水作用放出大量热,生成强碱,会烧伤口腔;碳酸钡溶于盐酸后生成有剧毒的氯化钡。只有氢氧化铝无副作用,对消化道无影响。
10.AD解析:Al既可以与酸反应放出H2,又可以和碱反应释放出H2:2Al+6H+=2Al3++3H2↑,2Al+2OH-+2H2O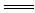 2AlO
2AlO +3H2↑,溶液中不可能同时含有大量的H+和OH-,因为H++OH-=H2O。故本题答案应选A、D。
+3H2↑,溶液中不可能同时含有大量的H+和OH-,因为H++OH-=H2O。故本题答案应选A、D。
9.AC解析:有关的化学反应方程式为:2Al+2NaOH+2H2O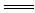 2NaAlO2+3H2↑,2Al+6HCl=2AlCl3+3H2↑。当铝不足量时,等量的铝失去等量的电子,生成等量的H2,天平保持平衡;当铝足量时,0.3molNaOH生成0.45molH2,0.3molHCl生成0.15molH2,左盘下沉。
2NaAlO2+3H2↑,2Al+6HCl=2AlCl3+3H2↑。当铝不足量时,等量的铝失去等量的电子,生成等量的H2,天平保持平衡;当铝足量时,0.3molNaOH生成0.45molH2,0.3molHCl生成0.15molH2,左盘下沉。
8.B解析:淬火是一种单纯热处理方法,只是对降低含碳量有效(将碳氧化成气体),所以选B。
7.C解析:合金的熔点低于其成分物质的熔点,生铁的熔点低是因为Fe和C形成了合金。所以本题的正确答案应选C。
6.D解析:A、B、C溶于盐酸后,溶液中即有Fe3+存在,滴加KSCN溶液会立即变红;而D溶于盐酸后,生成的是Fe2+,遇KSCN不变色,再滴加适量氯水,会将Fe2+氧化成Fe3+溶液立即呈红色。故答案选D。
5.B
4.D解析:依题意,当产生22.4L即1molH2时,消耗合金的质量为48g。而欲产生1molH2,所消耗的Na、Mg、Al质量分别为46g、24g、18g,均小于48g,它们两两组成合金均不合要求,只有Zn的质量65g>48g,所以,该合金中必含有Zn。
3.D解析:用盐酸可使铂丝上能影响下一次焰色反应实验的杂质转化为易清除掉的氯化物。
2.B解析:在题设条件下,如果氯化铁溶液足量,铁粉和铜粉都可与之完全反应,在此情况下,烧杯中既无铁也无铜。如果铁粉和铜粉足够多,氯化铁溶液相对不足,则反应后铁和铜都会存在。如果氯化铁溶液与铁粉、铜粉适量,则下列反应优先发生:Fe+2FeCl3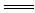 3FeCl2,这样,烧杯中将有铜,而铁粉没有剩余。无论如何有铁无铜的现象不可能存在。
3FeCl2,这样,烧杯中将有铜,而铁粉没有剩余。无论如何有铁无铜的现象不可能存在。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com