
题目列表(包括答案和解析)
24.(4分)电解饱和食盐水可产生氯气、氢气和氢氧化钠,氯气和石灰乳反应可制得漂白粉。
(1)若电解饱和食盐水的过程中有10 mol 电子发生转移,试计算理论上最多可制得氯气的体积(标准状况)是多少?。
(2)若将制得的氯气通入足量的石灰乳中,理论上可得到次氯酸钙多少克?
23.(8分) 据统计,2006年一季度江苏省粗钢产量为748.23万吨,同比增加254.86万吨;钢铁工业已成为我省重要的支柱产业。某大型铁矿附近有炼焦煤、石灰石、黏土矿和丰富的水资源。
(1) 随着铁矿的开发,该地建立了如下图所示位置关系的炼焦厂、钢铁厂、发电厂和水泥厂。

请写出图中B、D所代表的两个工厂的名称:B.____________;D.___________。
(2) 硫铁矿其外观如黄金,故其又被称为“愚人金”。现有黄金、愚人金两种小块试样,提供的仪器主要有:
A.托盘天平 B.酒精喷灯 C.试管夹 D.坩埚钳 E.烧杯 F.量简
另外,H2O、空气可任意选用,请回答问题:
① 若用物理方法来鉴别该黄金、愚人金试样,应选用的仪器为 (填代号);
② 若用化学方法来鉴别该黄金、愚人金试样,应选用的仪器为 (填代号)。
(3) 某发电厂每天排放1.12×103m3(标准状况)尾气,其中含0.02%(体积分数)的SO2,现欲用2.0.mol/L 氢氧化钠溶液进行处理,每天至少需要氢氧化钠溶液的体积是 L。
22.(10分) A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。
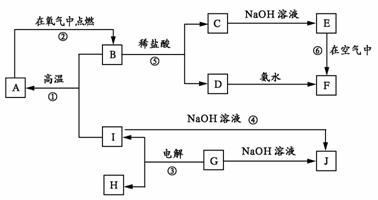
请填写下列空白:
(1) A、B、C、D、E、F六种物质中所含的同一种元素是 (写元素符号)。
(2) 写出物质C、G的化学式:C ,G 。
(3) 写出反应①、⑥的化学方程式:
反应①: 。
反应⑥: 。
21.(9分)写出下列反应的化学方程式或离子方程式。
(1)漂白粉溶液中通入过量的二氧化碳的化学方程式 ________ _______ ____________。
(2)足量的氯气通入到溴化亚铁溶液中的离子方程式____________________ _______。
(3)铝与氢氧化钠溶液反应的离子方程式_____________________________ _______。
(4)二氧化硫使溴水褪色的化学方程式并标出该反应中电子转移的方向和数目
_____________________________________________________________________________。
20. (10分) 某研究性学习小组认为SiO2、SO2和CO2都是
(10分) 某研究性学习小组认为SiO2、SO2和CO2都是
酸性氧化物,化学性质应具有一定的相似性,他们以
课本知识“Mg在点燃的条件下可与CO2反应”为基
础,设计了如右图所示装置进行Mg和SO2反应的实
验。据此请回答:
(1)若用下列物质中的两种相互混合反应制取SO2,则这两种物质最好是_______(填代号)。
① 10%的H2SO4溶液 ② 50%的H2SO4溶液 ③ Na2SO3固体 ④ CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式________________________________。
装置C中NaOH溶液的作用是________________________________________。
(3)你认为该装置是否有不足之处?如果有,请说明之。答:______________ __________
_________________________________________。
(4)有同学认为,B管中的生成物中含有MgS,请你设计实验方案加以证明。答:_____________
__________________________________________________________________。
19.(5分)下列有关实验操作或判断不正确的是 _____________(填序号,多选扣分)。
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大。
B.用干燥的pH试纸测定氯水的pH。
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌。
D.100 mL容量瓶可用于配制95 mL 0.1 mol/L NaCl溶液。
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量。
F.观察钾元素焰色反应的操作是:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
G.苯、CCl4、酒精可用来萃取溴水中的溴。
2.答卷前将密封线内的项目填写清楚。
18. 在保持平衡的天平的左右两盘中各放一只大小和质量均相同的烧杯,两烧杯中都盛有1?mol/L的稀硫酸100?mL,然后分别向两烧杯中加入一定质量的金属,充分反应后天平仍保持平衡,则金属的质量分别是( )
A.4.6 g Na,4.8 g Mg B.5 g Na,5 g Al
C.2.3 g Na,2 .4 g Mg D.1.8 g Al,2.4 g Mg
高一化学第一学期期末考试
高一化学试题
第二卷 (非选择题 共54分)
l.用钢笔或圆珠笔(除题目有特殊规定外)直接答在试卷上。
17.下列叙述正确的是( )
A.某可溶性物质的摩尔质量大于18 g/mol,则该物质的浓溶液的密度一定大于1 g/cm3
B.某温度时,NaCl饱和溶液的质量分数为a %,NaCl的溶解度为S g,则a一定大于S
C.将90 %的H2SO4溶液与10 %的H2SO4溶液等体积混合,所得混合溶液中H2SO4的质量分数一定等于50 %
D.饱和KCl溶液的密度为ρg/cm3,物质的量浓度为c mol/L,则此溶液中KCl的质量分数为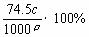
16.下列混合物的分离或提纯操作中不正确的是( )
A.除去N2中的少量O2,可通过灼热的Cu网,收集气体
B.除去Fe(OH)3胶体中混有的Cl-离子,可用过滤的方法
C.除去乙醇中的少量NaCl,可用蒸馏的方法
D.重结晶、萃取操作都可用于提纯物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com