
题目列表(包括答案和解析)
2.氧化还原反应的实质是 ( )
A. 分子中的原子重新组合 B. 氧元素的得失
C. 化合价的升降 D. 电子的得失或共用电子对的偏移
1.下列反应中属于氧化还原反应的是 ( )
A. Cu2(OH)2CO3 2CuO+H2O+CO2 B. Na2O+H2O = 2NaOH
2CuO+H2O+CO2 B. Na2O+H2O = 2NaOH
C. 2CO+O2 2CO2
D. Na2CO3+CaCl2 = CaCO3↓+2NaCl
2CO2
D. Na2CO3+CaCl2 = CaCO3↓+2NaCl
(本题供学有余力的同学做,记入总分,但不超过100分)
33、合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4∶5,其中Fe2+ 与Fe3+ 物质的量之比为 。
(2)当催化剂中Fe2+ 与Fe3+ 的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为 (可用分数表示;若用小数表示,请保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2 Fe2O3+C == 4FeO+CO2↑。为制得这种活性最高的催化剂,应向480gFe2O3 粉末中加入炭粉的质量为 g
32、一个体重50 kg的健康人约含铁2 g。正常人体每日需铁量为11.5 mg。某种补铁药品标签上注明:每 100 mL 含 FeSO4 450 -460 mg 。实验室为测定这种补铁药品的含铁量,做了以下实验:
取 20.00 mL 该药品,用0.010 00 mol/L KMnO4 溶液滴定,当加入到 12.00 mL 时,紫色不再褪去,反应的离子方程式为: MnO4- + 5 Fe2+ + 8 H+ = Mn2+ + 5 Fe3+ + 4 H2O
问:(1)20.00 mL 溶液中含Fe2+ 的物质的量是多少?
(2)通过计算说明,测得的结果是否符合药品标签上的注明范围?
(没有计算过程,此题得 0 分)
31、完成下题中的空格部分
实验室制配1.00 mol/L的NaOH溶液500 mL,有以下仪器:① 烧杯 ②100 mL量筒
③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦分液漏斗
(1)配制时,必须使用的仪器有____________(填代号),
还缺少的仪器是(填名称)___ 。
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:
① 计算 需NaOH质量_____g。
② 称量 用天平准确称取所需氢氧化钠固体。
③ 溶解 向氢氧化钠固体中加入少量___________,用玻璃棒慢慢搅动,使其完全溶解,
__________________________。
④ 转移 将烧杯中的溶液用玻璃棒小心的引流到 _____________________中,用蒸馏水洗涤烧杯内壁2-3次,并将每次洗涤液都注入容量瓶中,轻轻振荡容量瓶,使溶液混合均匀。
⑤ 定容 继续缓缓往容量瓶内加水,直到液面接近刻度1-2 cm处,改用________加水,使溶液凹面恰好与________________。再将容量瓶塞盖好,反复上下颠倒,摇匀。
(4)试分析下列变化并用“偏大”“偏小”或“不变”填写:
① 小烧杯、玻璃棒没洗涤,溶液中溶质的浓度 。
② 所用容量瓶中,已有少量蒸馏水,则溶液中溶质的浓度 。
③ 转移时不慎将溶液倒在瓶外,溶液中溶质的浓度 。
④ 定容时视线未平视液面,若俯视会使体积偏小,则溶液中溶质的浓度 。
(5)若配制时,因滴加蒸馏水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?
答: 。
30、选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液B.升华C.结晶D.分液 E.蒸馏 F.层 析 G.过滤
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
29、镁和氢氧化钾都是重要的工业产品。请回答:
(1)工业上电解氯化镁制取镁的化学方程式是 。
(2)氯化镁溶液与氢氧化钾溶液反应的离子方程式是 。
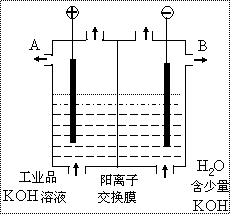 (3)工业品氢氧化钾的溶液中含有某些含氧酸根杂
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂
质,可用离子交换膜法电解提纯(类似于氯化
钠溶液的电解)。电解槽内装有阳离子交换膜
(只允许阳离子通过),其工作原理如图所示。
① 通电开始后,与电源_______极
(填正、负)相连的一极附近溶
液的pH会增大
② 除去杂质后的氢氧化钾溶液从
液体出口 (填写“A”或“B”)
28、下图所涉及的物质均为中学化学中的常见物质,其中
(1)C、D、E、F都为单质,其余为化合物
(2)C、D、E 在常温下为气体,其它物质为固体或液体
(3)A、I 两种化合物的焰色反应分别为紫色和黄色
(4)反应 ① ② 的一些生成物已经略去,有些反应的条件未列出
它们存在如下转化关系。
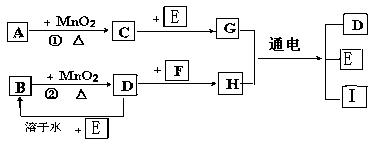
(1)写出有关物质的名称或化学式:
A ,D ,F ,I 。
(2)指出MnO2在相关反应中的作用:反应 ① 中是 剂,反应 ② 中是 剂。
(3)写出B与MnO2共热获得D的化学方程式 ______ 。
(4)写出G 、H混合液通电后发生反应的化学方程式______________________________。
27、化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是___________ 。
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时)。
___________________________________ ;_____________________________________。
26、KMnO4 与浓度为12.0 mol/L 的浓盐酸在常温下就可以反应,实验室有时就用这种方法制取少量氯气。反应方程式如下:
2 KMnO4 + 16 HCl = 2 KCl + 2 MnCl 2+ 5Cl 2↑ + 8 H2O
其中氧化剂是 ,氧化产物是 。在方程式上标明电子转移的方向和数目。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com