
题目列表(包括答案和解析)
24.(10分)用Na2SO3可以治理工业SO2尾气污染,这是一种治理SO2尾气污染比较新颖的方法。具体操作是:①将含有SO2气体的工厂尾气通入到Na2SO3溶液中,使其吸收尾气中含有的SO2气体并转化为NaHSO3;②将富集有SO2气体的溶液加热,即可使其中的SO2气体逸出,这些SO2气体可以应用于制取H2SO4。该方法中Na2SO3可以循环使用,符合绿色化学的基本原则。请根据上述信息解答下列试题:
⑴写出①、②两步的化学方程式:
① ;
② 。
⑵今有10 m3的0.1 mol·L-1 的Na2SO3溶液,每次吸收标准状况下的含有SO2气体的尾气89.6 m3后,即达到了饱和状态。试求该工厂产生的尾气中SO2气体的体积分数是多少。
23.(10分)据最新文献报道,可用如下步骤合成1,2-二溴乙烷:在装有温度计的干燥的三口烧瓶中,加入少许干沙,在室温下先向瓶中加入约l0 mL的无水乙醇和焦磷酸配成的混合溶液,加热到180 ℃-190 ℃,从滴液漏斗中开始滴加剩余的混合溶液,使反应平稳进行,乙烯气体经碱洗、干燥,通入装有液溴的反应瓶中,反应结束后,粗产品蒸馏,收集129 ℃-133 ℃的组分即得到产物1,2-二溴乙烷。
⑴由乙醇脱水得到乙烯的化学方程式是______________________________________,由乙烯合成1,2-二溴乙烷的化学方程式是_________________________________。
⑵如取59.8 g无水乙醇,55.2 g液溴,得到56.4 g产物,试计算1,2-二溴乙烷的产率。(产率= ,计算结果取3位小数)
,计算结果取3位小数)
22.(8分)A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
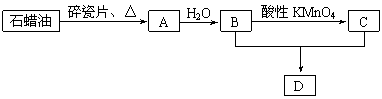
⑴工业上,由石油获得石蜡油的方法是_________,由石蜡油获得A是________变化。
⑵A→B的反应类型是____________________;写出反应B+C→D的化学方程式:_______________________________________。
⑶丁烷是由石蜡油获得A的过程中的中间产物之一,写出它的两种同分异构体的结构简式:________________________________________________。
21.(8分)由于苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康。因此,加强苏丹红的监管对维护人们健康和社会稳定十分重要。苏丹红Ⅰ号的分子结构如图1所示。
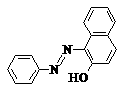
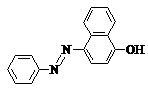
图1 苏丹红Ⅰ号的分子结构 图2 修饰后的分子结构
⑴苏丹红Ⅰ号分子中的氮原子杂化类型是________;该分子中含有的官能团“-OH”的名称是 。
⑵2-丁烯分子中由于双键不好旋转,使得它有两种空间异构体:
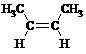
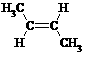
顺式异构体 反式异构体
苏丹红Ⅰ号也有两种这样的空间异构体,图1所示就是其反式异构体,可简写为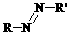 ,则苏丹红Ⅰ号的顺式异构体的结构简式为____________________。
,则苏丹红Ⅰ号的顺式异构体的结构简式为____________________。
⑶苏丹红Ⅰ号易形成分子内氢键,在水中的溶解度很小。有人把羟基取代在对位形成图2所示结构,其溶解度会增大,原因是__________________________________。
20.(10分)已知:①红磷在氯气中燃烧可以生成两种化合物--PCl3和PCl5,氮与氢也可形成两种化合物--NH3和NH5。
②PCl5分子中,P原子的一个3s轨道、三个3p轨道和一个3d轨道发生混杂形成5个sp3d杂化轨道,PCl5分子呈三角双锥型(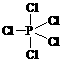 )。
)。
⑴NH3、PCl3和PCl5分子中,所有原子的最外层电子数都是8个的是_______(填分子式),该分子的形状是_________。
⑵有同学认为,NH5与PCl5类似,N原子的一个2s轨道、三个2p轨道和一个2d轨道可能发生sp3d杂化。请你对该同学的观点进行评价_______________________________。
⑶经测定,NH5中存在离子键,N原子最外层电子数是8,所有氢原子的最外层电子数都是2,则NH5的电子式是___________。
19.(8分)两种位于不同短周期元素X、Y,其原子序数相差4,X的基态原子的价电子层排布为 ns1,Y的基态原子的价电子层排布为 ns2np3,它们能形成两种化合物X3Y和XY3。
⑴画出Y原子的电子排布图(轨道表示式):____________________________。
⑵请用“>”或“<”比较原子半径或离子半径的大小:
r(X)_______r(Y) r(X+)_______r(Y3-)
⑶下列各图中,可能是X3Y晶体晶胞的是______(“○”表示阳离子,“●”表示阴离子,大图表示晶胞,小图表示晶胞的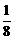 )。
)。
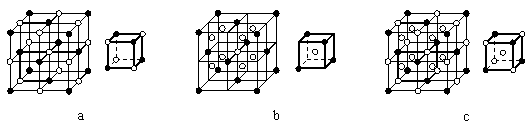
⑷XY3中的阴离子与CO2是等电子体,则该阴离子的空间构型是______________。
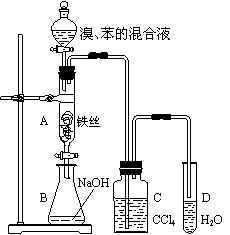
18.(10分)某化学课外小组用右图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。
⑴写出A中反应的化学方程式:_____________
___________________________。
⑵实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_______________________
_________________。
⑶C中盛放CCl4的作用是_______________________
________________。
⑷若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
|
|
向试管D中加入的试剂 |
能证明苯与液溴发生取代反应的现象 |
|
方法一 |
|
|
|
方法二 |
|
|
17. (8分)为定性探究乙醇的分子结构,某化学课外小组设计了如下实验方案:在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有医用注射针头的单孔塞,点燃放出的气体,并把一干燥的小烧杯罩在火焰上(如图),在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量的澄清石灰水,观察有无混浊。
(8分)为定性探究乙醇的分子结构,某化学课外小组设计了如下实验方案:在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有医用注射针头的单孔塞,点燃放出的气体,并把一干燥的小烧杯罩在火焰上(如图),在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量的澄清石灰水,观察有无混浊。
⑴以上实验设计存在重大安全隐患,请你帮他们指出来:________________________ ___________________。
⑵确认所用乙醇为无水乙醇的方法是______________________________________。
⑶若向烧杯中加入少量澄清石灰水后发现有混浊,那么燃烧产生CO2的物质最可能是_________________。
 ⑷若向烧杯中加入少量澄清石灰水后未发现混浊,则可推断乙醇分子结构中含有__________________________________________。
⑷若向烧杯中加入少量澄清石灰水后未发现混浊,则可推断乙醇分子结构中含有__________________________________________。
16.下表是元素周期表中第一、第二周期10种元素的电离能数据(单位:eV),除带“……”的四种元素外,其余元素都给出了该种元素的全部该类数据。
|
(H) 13.6 |
|
(He) 24.6 54.4 |
|||||
|
(Li) 5.4 75.6 122.5 |
(Be) 9.3 18.2 153.9 217.7 |
(B) 8.3 25.2 37.9 259.4 340.2 |
(C) 11.3 24.4 47.9 64.5 392.1 489.9 |
(N) 14.5 29.6 47.4 72.5 97.9 552.1 …… |
(O) 13.6 35.1 …… …… …… …… …… …… |
(F) 17.4 34.9 …… …… …… …… …… …… …… |
(Ne) 21.6 41.6 …… …… …… …… …… …… …… …… |
研究这些数据,从中找出规律,判断氧元素8个数据中出现“突跃”的数据应该是
A.第4个 B.第6个 C.第7个 D.第8个
第Ⅱ卷(非选择题 共72分)
15.乙醇催化氧化为乙醛过程中化学键的断裂与形成情况可表示如下:
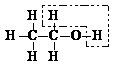

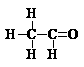 (注:含-CHO的物质为醛类化合物)
(注:含-CHO的物质为醛类化合物)
下列醇能被氧化为醛类化合物的是
A.(CH3)3COH
B.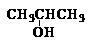
C.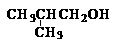 D.CH3CH2CH2OH
D.CH3CH2CH2OH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com