
题目列表(包括答案和解析)
1、科学家研究发现,用“汽水”(一种能释放CO2的弱酸性溶液)浇灌植物能促进植物的生长。原因是它能
① 加强呼吸作用 ② 加强光合作用
③ 改良碱性土壤、调节pH值 ④ 加强植物蒸腾作用
A. ①② B. ②③ C.③④ D.②③④
25.(6分)已知X、M、N为周期表中1-20号元素,
(1) X的最高正化合价与最低负化合价的代数和为4,且X在最高价氧化物中的质量分数为40%,则X在周期表中的位置是________________________;
(2)4.5 g金属单质M与足量的硫酸溶液完全反应放出氢气,电子转移的个数为3.01×1023,则该金属M是___________;
(3) N元素的同位素AZN,它的氯化物NCl2 2.22 g溶于水制成溶液后,加入2 mol·L-1的AgNO3溶液20 mL,恰好完全反应。若这种同位素原子核内有20个中子,则Z=____________。
高一化学第二学期期末调研测试试题
24.(6分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:
4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·L-1·min-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
23.(8分)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,
用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过
热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
|
H:2.1 |
|
|
|
|
|
|
|
Li:1.0 |
Be:1.5 |
B:2.0 |
C:2.5 |
N:3.0 |
O:3.5 |
F:4.0 |
|
Na:0.9 |
Mg:1.2 |
Al:1.5 |
Si:1.8 |
P:2.1 |
S:2.5 |
Cl:3.0 |
|
K:0.8 |
Ca:1.0 |
Ga:1.6 |
Ge:1.8 |
As:2.0 |
Se:2.4 |
Br:2.8 |
|
Rb:0.8 |
Sr:1.0 |
In:1.7 |
Sn:1.8 |
Sb:1.9 |
Te:χ |
I:2.5 |
|
Cs:0.7 |
Ba:0.9 |
Tl:1.8 |
Pb:1.9 |
Bi:1.9 |
Po:2.0 |
At:2.2 |
|
Fr:0.7 |
Ra:0.9 |
|
|
|
|
|
请仔细分析,回答下列问题:
(1)你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小? ;
(2)预测Te元素χ的值 ;
(3)根据表中所给数据分析研究推测:
同主族的不同元素的电负性变化的规律是___________________________________;同周期中,电负性与原子半径的关系为________________________________。
(4)一般认为,当两种成键元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。根据H和F的电负性差值能否判断HF是离子化合物,并说明理由: ;
。
(5)2005年1月美国科学家在《Science》上发表论文,宣布发现了Al的超原子结构Al13和Al14,并预言其它金属原子也可能存在类似的结构。这种超原子具有40个价电子时最稳定。请预测Al14与周期表中 族元素的性质相似。
22.(9分)A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ;C元素原子的轨道表示式是 ;D元素原子的外围电子排布式是 ;A2B2的电子式是 ;
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;
(3)写出B、D、E三种元素中两种元素形成的化合物的化学式 (不
少于四种)。
21.(11分)下表是元素周期表的一部分:
|
族 周期 |
I A |
IIA |
IIIA |
IVA |
VA |
VI A |
VIIA |
0 |
|
1 |
① |
|
|
|||||
|
2 |
|
|
|
|
② |
③ |
④ |
⑤ |
|
3 |
|
⑥ |
⑦ |
|
|
⑧ |
⑨ |
|
|
4 |
⑩ |
|
|
|
|
|
|
|
请从上表①-⑩十种元素中选择适当的元素符号回答下列问题:
(1)金属性最强的是 ,电负性最大的是 ,原子半径最小的是 ,第一电离能最大的是 ;
(2)用电子式表示⑥和⑨形成化合物的过程 ;
(3)⑥、⑦两元素的第一电离能的大小:⑥ ⑦(填“>”、“<”符号;下同);③、⑧两元素形成的氢化物沸点高低顺序为:③ ⑧;
(4)写出⑦的最高价氧化物的水化物与⑧的最高价氧化物的水化物反应的离子方程式 ;
(5)表中元素形成的多核10电子阴离子的化学式为 。
19.(5分)在下列①NH3、②NH4Cl、③金刚石、④KBr、⑤甲烷、⑥CO2、⑦Ar七种物质中,请用编号填空:其中只含有离子键的是 ,只含有共价键且为直线型分子的是 ,空间构型为正四面体结构的分子是 ,熔点最高的是 ,不存在化学键的物质是 。
18.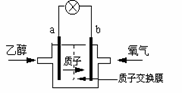 一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH
+3O2=2CO2
+3H2O。下列说法不正确的是
一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH
+3O2=2CO2
+3H2O。下列说法不正确的是
A.a极为电池的正极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e- = 2H2O
D.每消耗1 mol乙醇,反应中转移电子数为6 NA
高一化学第二学期期末调研测试试题
高 一 化 学(选修)
第Ⅰ卷(选择题 共44 分)
第Ⅰ卷答题栏
第Ⅱ卷(非选择题 共56 分)
17.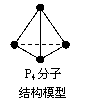 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.常温常压下,16 g 14CH4所含中子数为8×6.02×1023
B.电解精炼铜当转移0.2×6.02×1023个电子时阳极溶解6.4 g铜
C.30 g二氧化硅晶体中含硅氧共价键的数目为2×6.02×1023
D.6.2 g白磷P4(右图)中所含的P-P键的个数为0.2×6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com