
题目列表(包括答案和解析)
18、(1)根据氢元素最高正价最低负价的绝对值相等,有人提议把氢元素放在周期表中的ⅣA族。那么根据NaH的存在,又可把氢元素放在 族。
(2)某元素X的核外电子数等于核内中子数,取该元素单质2.8g与足量氧气充分反应,可得6g化合物XO2,则该元素在周期表中的位置是 。
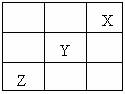 (3)短周期元素X、Y、Z在周期表中的位置关系如图所示,则①Y、Z元素的气态氢化物的稳定性 > (填化学式)。
(3)短周期元素X、Y、Z在周期表中的位置关系如图所示,则①Y、Z元素的气态氢化物的稳定性 > (填化学式)。
②与Y元素同主族且相邻的元素的单质与NaOH溶液反应的离子方程式为
17、某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、铝粉、钠、新制的Na2S溶液,新制的氯水,0.5mol/L的盐酸,3mol/L的盐酸,酚酞试液,
其设计的实验方案及部分实验现象如下表:
|
实验步骤 |
实验现象 |
|
①将一小块金属钠放入滴有酚酞试液的冷水中 |
钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
|
②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 |
镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
|
③将新制的氯水滴加到新制的Na2S溶液中 |
|
|
④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 |
剧烈反应产生气体,但铝粉消失比镁条快 |
请回答下列问题:
(1)实验③的现象是 ,该反应的离子方程式为 ,
(2)由实验③得出的实验结论是
(3)由实验②可得出决定化学反应快慢的主要因素是
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确? (填是或否)
(5)通过实验④说明要加快化学反应速率可 或 。
16、(1)写出表示含有8个质子,10个中子的原子的化学符号:
(2)已知阴离子aXm-和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a= 。
(3)元素周期表中,所含元素超过18种的是 。
15、( )元素X能分别与元素B、N、O形成二元化合物(即只含有两种元素的化合物),它们的相对分子质量依次为68、71和54,在这些二元化合物中X元素的质量分数依次是83.8%、80.3%、70.3%。则下列说法正确的是
A、X可能是氢元素 B、X可能是钠元素
C、X可能是氟元素 D、仅依据上述条件还不能确定X是何种元素
14、( )可逆反应达到化学平衡的标志是
A、正、逆反应不再进行 B、反应物的浓度为零
C、正、逆反应都还在继续进行 D、正、逆反应的速率相等
12、( )下列说法正确的是
A、共价化合物中一定不含离子键 B、离子化和物中一定不含共价键
C、金属元素和非金属元素之间形成的化学键一定是离子键
D、全部由非金属元素形成的化合物一定是共价化合物
 (
)13、将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是
(
)13、将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是
A、甲装置子中电能转化为化学能 B、乙装置中电能转化为化学能
C、甲装置中铜片表面有气泡产生 D、乙装置中铜片表面有气泡生成
11、( )下列说法中,不正确的是
A、若反应时形成新化学键释放的能量大于破坏旧化学键所吸收的能量,则化学反应是释放能量的反应
B、若反应物的总能量大于生成物的总能量,则化学反应为释放能量的反应
C、Ba(OH)2.8H2O晶体与NH4Cl固体的反应是放热反应
D、化学反应在发生物质变化的同时,一定伴随着能量的变化
10、( )用锌粒与稀盐酸反应制取氢气时,下列措施不能使氢气的生成速率增大的是
A、升高反应体系的温度 B、增加锌粒的用量
C、不用锌粒,改用锌粉 D、加入少量的浓硫酸
9、( )某研究性学习小组为了探究镁粉与溴水反应的机理,做了如下四种实验:①将镁粉投入到冷水中,未观察到明显现象;②将镁粉投入到溴水中,观察到只是开始时产生极少量的气泡,但溴水会慢慢退色;③将镁粉投入到液溴中,未观察到明显现象;④向含有足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快退去。下列关于镁粉与溴水的反应机理的叙述中正确的是
A、镁粉只直接与溴水中的溴反应 B、镁粉只与溴水中的酸反应
C、产生极少量的气泡是由于镁粉与水反应得到的 D、镁粉在水的催化下与溴发生反应
8、( )下列各数值表示有关元素的原子序数,它们所表示的各组原子中,能以共价键相互结合形成稳定化合物的是
A、11与9 B、17与17 C、16与8 D、2与8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com