
题目列表(包括答案和解析)
4.下列化学方程式中电子转移不正确的是 ( )
3.下列哪一个反应表示二氧化硫被还原 ( )
A.SO2+2H2O+Cl2=H2SO4+2HCl B.SO2+H2S=2H2O+3S
C.SO2+2NaOH=Na2SO3+H2O D.SO2+Na2CO3=Na2SO3+CO2↑
2.下列化学反应基本类型中一定是氧化还原反就的是 ( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
1.有关氧化还原反应的叙述正确的是 ( )
A.氧化还原反应的实质是有氧元素的得失
B.氧化还原反应的实质是元素化合价的升降
C.氧化还原反应的实质是电子的转移(得失或偏移)
D.物质所含元素化合价升高的反应是还原反应
39.(4分)将Na2CO3、NaHCO3的混合物1.9g,强热至无气体出现为止,恢复至原来状态,称量剩余物的质量减轻了0.31g,求原混合物中NaHCO3质量分数。
38. (6分)某种待测浓度的H2SO4溶液20mL,加入10mL0.5mol/LBaCl2溶液,恰好完全反应。问(1)得到BaSO4沉淀多少克?(2)待测H2SO4溶液的物质的量浓度是多少?
37、(2分)2.7 g Al 物质的量为_________ 。与足的盐酸反应生成H2的体积为____________ (在标准状况下)。
36.(5分)回答问题:
(1)(3分)甲、乙两试管分别盛有5 mLFeCl3溶液和5 mLFeCl2溶液,各滴入几滴KSCN溶液。填写下表:
|
试 样 |
滴入KSCN溶液后的现象 |
两试管里产生不同的现象有何用途 |
|
甲试管(FeCl3) |
|
|
|
乙试管(FeCl2) |
|
(2)(2分)在盛有3 mLFeCl3溶液的试管中加入少量铁粉,若充分反应后没有固体物剩余。该试管的溶液中存在什么金属阳离子?如何进一步得到肯定答案?
_____________________________________________________________________
_____________________________________________________________________
_____________________________________________________________________
35、(2分)为了除去下表中各物质所含的杂质(括号内的物质),请完成下面表格
|
物 质 |
除杂试剂 |
分离方法 |
有关的离子方程式为 |
|
CuO(Al2O3) |
|
|
|
|
Na2CO3(NaHCO3) |
――――― |
|
|
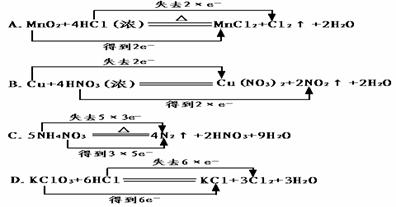
34、(3分)用双线桥法表示下列氧化还原反应电子转移情况,并指出氧化剂。

MnO2 + 4HCl(浓) = MnCl2 + 2H2O + Cl2↑ 氧化剂 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com