
题目列表(包括答案和解析)
1.(10分)已知反应:2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O。该反应中H2O2只发生如下变化过程:H2O2→O2。
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是 →
(3)在反应方程式中用单线桥法标明电子转移的方向和数目:
2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
(4)如反应中转移了0.3mol电子,则产生的气体在标准状况下体积为
27.(10分)将铁与氧化铁的锟合物15g,加入150mL稀H2SO4中,标准状况下放出H2 1.68L,同时铁和氧化铁均无剩余,向溶液中滴入KSCN溶液,未见颜色变化。
(1)写出所有发生的反应方程式:
(2)混合物中铁的质量是 克。
(3)为了中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,共耗费3mol/L的氢氧化钠溶液200mL,则原硫酸的物质的量浓度为 。
26.(6分)有一块质量为15.4g的团体,经确认是表面氧化为Na2O的金属钠,将它投入到200g水中完全反应,收集到0.4g氢气,最终所得溶液约为200mL,试计算:
(1)未被氧化的金属钠质量为多少?
(2)表面已被氧化的金属钠质量为多少?
(3)溶液中溶质的物质的量浓度为多少?
25.(10分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、KCl等混合而成,为检验它们,做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加BaCl2溶液,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解。
试判断:
(1)固体混合物中肯定有 ,肯定没有 ,可能有 。
(2)写出实验③中的离子方程式: 。
(3)对可能有的物质进行确认,把③的滤液做进一步鉴别操作,写出你所设计的实验方案(包括具体操作步骤和实验现象) 。
24.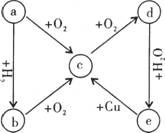 (12分)a单质及其化合物在一定条件下可发生如右图所示的
(12分)a单质及其化合物在一定条件下可发生如右图所示的
变化,五种物质中都含有同一种元素。
(1)若a常温下是一种固体,则a是 ,c是 。
e→c的化学方程式为 。
(2)若a常温下是一种气体,则a是 ,d是 。
e→c的离子方程式为 。
23.(6分)按要求完成有关方程式(第(1)、(2)小题写化学方程式,第(3)小题写离子方程式)。
(1)镁在CO2中燃烧 。
(2)Fe(OH)2被空气氧化 。
(3)除去Na2CO3溶液中混有的NaHCO3 。
22.(12分)含镁3%-5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要原材料。
现有一块质量为mg的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验
方案。
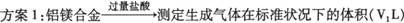
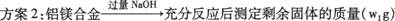
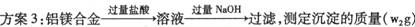
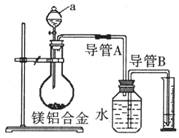 回答下列问题:
回答下列问题:
(1)某化学实验小组利用右图所示实验装置,按照方案1
进行了实验。请问装置中仪器a的名称是 。
(2)方案2中发生反应的化学方程式为 。
(3)方案3“过滤”操作中用到玻璃棒,玻璃棒的作用是 ,
若按方案3进行实验,测得的镁的质量分数为 。
(4)在正确操作的前提下评价以上三个实验方案中误差最小的是 ;
理由是 。
21.(4分)下列说法或操作正确的是
A.做过碘升华的烧杯和圆底烧瓶可以用四氯化碳或氢氧化钠溶液洗涤
B.做实验时可用手直接拿取金属钠
C.用托盘天平称量50.56gKCl
D.用煤油可以从饱和碘水中萃取碘
E.让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路"
F.从含有少量氯化钠的硝酸钾溶液中提取硝酸钾可用结晶的方法
G.用淀粉碘化钾试纸去检验溶液中是否含有氧化性物质,正确操作是先用蒸馏水润湿试
纸,将其粘在玻璃棒一端,然后将试纸伸入溶液中,看试纸颜色是否变蓝
20.有10.2g镁和铝的混和粉末溶于500mL 4mol·L-1的盐酸中。若加入2mol·L-1的氢氧化钠溶液,要使产生的沉淀的质量最大,则需加入的氢氧化钠溶液的体积为
A.100ml B.500mL C.1000mL D.1500mL
19.下列离子方程式正确的是
A.铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
B.氯气跟水反应:C12+H2O=2H++C1-+C1O-
C.钠跟水反应:Na+2H2O=Na++2OH-+H2↑
D.氯化铁溶液中加入铜片Fe3++Cu=Fe2++Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com