
题目列表(包括答案和解析)
22.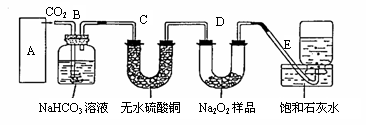 (8分)过氧化钠是一种淡黄色固体,它能与二氧化碳反应,在潜水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和一定量过氧化钠样品为原料,制取O2, 设计出如下实验装置:
(8分)过氧化钠是一种淡黄色固体,它能与二氧化碳反应,在潜水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和一定量过氧化钠样品为原料,制取O2, 设计出如下实验装置:
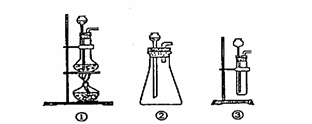
(1)A是制取CO2 的装置,
应从下列图①、②、③中最好选哪个图:
(2)B装置的作用是吸收A装置中产生的盐酸酸雾,C装置的作用是 。C装置内可能出现什么现象? 。
(3)在取出集气瓶后,如何检验E中收集到的气体 。
21、(8分)胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,受热可缓缓分解;②能溶于水,水溶液呈弱碱性;灼烧时火焰为黄色;③遇酸及酸性药物则产生二氧化碳;④患者服用过量,可能引起胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸是中和作用缓慢而持久,可维持3-4小时;②凝胶本身覆盖于溃疡面上,具有保护作用;③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:
。
(3)三硅酸镁Mg2Si3O8·nH2O也是常用胃药,被用来治疗胃溃疡,是因为该物质不溶于水,服用后中和胃酸作用持久。把三硅酸镁改写成氧化物形式为:_____ ____。
20、(12分)氧化还原反应在工农业生产和日常生活中有广泛运用
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是 。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有 。 (填“氧化性”或“还原性”);
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是 。(填“氧化作用”或“还原作用”);
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 。
如果药片已经失效,应如何检验?写出主要操作与现象: 。
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式 。
19、(8分)我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应: KIO3+ KI+ H2SO4=== K2SO4+ I2+ H2O
(1) 将上面氧化还原反应的化学方程式配平
(2)该反应中氧化剂和还原剂的物质的量之比为 。
(3)如果反应中转移0.2mol电子,则生成I2的物质的量为_________________。
(4)利用上述反应检验食盐中是否加碘,所需试剂是________________(填下列选项的序号)
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸 ⑤AgNO3溶液
18、将5.6LCO2气体缓慢通过一定量的Na2O2固体后,得到3.36L气体(气体体积均在标准状况下测定),所得气体的质量为
A.3.8g B.4.8g C.5.4g D.6.6g
第Ⅱ卷(非选择题 共58分 请将答案写在答卷纸上)
17、由Zn、Fe、Al、Mg四种金属中的两种组成的混合物13g,与足量的盐酸反应产生的氢气在标况下为11.2升,则混合物可能的组成是 C
A.Zn和Fe B.Fe和Al C. Al和Mg D.Mg和Fe
16、下列各组离子中可能在某无色溶液中大量共存的是AB
A.MnO4-、K+、Na+、SO42- B.K+, H+, CO32-, Cl-
C.Mg2+、NH4+、Cl-、NO3- D.Ba2+、K+、HCO3-、Cl-
15、下列叙述中正确的是
A、含金属元素的离子,不一定都是阳离子
B、在氧化还原反应中,非金属单质一定是氧化剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、金属阳离子被还原不一定得到金属单质
14、已知常温下在溶液中可发生如下两个离子反应:Ce4+ + Fe2+ = Fe3++ Ce3+ ,Sn2+ + 2Fe3+ =2 Fe2++ Sn4+ 。由此可以确定Fe2+、Ce3+、Sn2+ 三种离子的还原性由强到弱的顺序是
A.Sn2+ 、Fe2+、Ce3+ B.Sn2+ 、Ce3+ 、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+ 、Ce3+
13、把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为
A.1︰1 B.2︰5 C.4︰1 D.3︰1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com