
题目列表(包括答案和解析)
4.胶体区别于其他分散系的本质特征是:
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1nm-100nm之间
D.胶体在一定条件下能稳定存在
3.下列的分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙 B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘 D.用淘洗的方法从沙里淘金
2.鉴别氯化铁溶液与氢氧化铁胶体最简便的方法是
A.萃取 B.蒸馏 C.过滤 D.丁达尔效应
1.下列仪器中,具有能溶解固体、配制溶液、加热较多试剂三种用途的是
A.容量瓶 B.烧杯 C.量筒 D.试管
20.(8分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到2.24 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.54g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.09mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。(3分)
(2)试通过计算确定该钠块中钠元素的质量分数。(5分)
19.(6分) 取1.06g Na2CO3 溶于水配成10 mL 溶液,再往该溶液逐滴加入1mol/L的稀盐酸15mL并不断搅拌使之反应。
求:(1)写出相关离子方程式 (2)该 Na2CO3 溶液的物质的量浓度
(3)标准状况下,生成气体的体积
18.(12分)有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、NO3-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:

第③个实验中,生成白色沉淀的量与加入NaOH的量有右图所示的相互关系。据此可知:
 ⑴在原溶液中一定不存在的离子有_____________________,
⑴在原溶液中一定不存在的离子有_____________________,
⑵为满足该溶液中一定存在的离子的要求,一般可溶解两
种常见物质为(写化学式)___________和_________。
⑶写出第③个实验中发生反应的离子方程式
。
17.(12分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
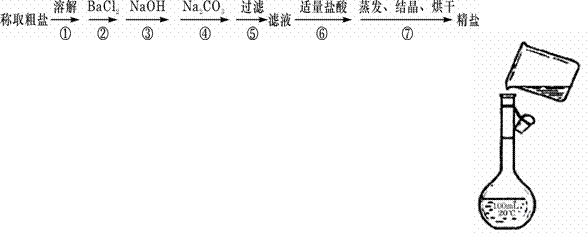
(1)判断BaCl2已过量的方法是_________________________________。
(2)第④步中,相关的离子方程式是_____________________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
_____________________________。
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,
右图是该同学转移溶液的示意图,图中的错误是____________________
_______________________________________________。
16.(6分)有两包白色粉末,只知分别是K2CO3和NaHCO3,请你写出鉴别方法
(1): 。
(2): 。
(3): 。
15、(8分)我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应: KIO3+ KI+ H2SO4=== K2SO4+ I2+ H2O
(1) 将上面氧化还原反应的化学方程式配平
(2)该反应中氧化剂和还原剂的物质的量之比为 。
(3)如果反应中转移0.2mol电子,则生成I2的物质的量为_________________。
(4)利用上述反应检验食盐中是否加碘,所需试剂是________________(填下列选项的序号)
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸 ⑤AgNO3溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com