
题目列表(包括答案和解析)
25.下列变化不能经过一步实验直接完成的是
A.Al(OH)3→Al2O3 B..Al2O3→Al(OH)3
C.Al→AlO2- D. Al3+→Al(OH)3
24.下列各组微粒中,在一定条件下均可以做氧化剂的是
A.Fe、SO2、CO2 B.S、HCl、SO2
C.Cl2、HClO、Mg D.ClO-、Cl、Ag+
23.氢化钙中的氢元素为-1价,它可用做生氢剂,反应的化学方程式是:CaH2 + 2H2O == Ca(OH)2 +2H2↑。该反应中,水的作用是
A.溶剂 B.还原剂
C.氧化剂 D.既是还原剂又是氧化剂
22.一定条件下硝酸铵受热分解的化学方程式为:
5NH4NO3 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶4 B.5∶3 C.1∶1 D.3∶5
21.某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为( )
A.1∶2 B.1∶4 C.3∶4 D.3∶2
20.证明溶液中是否有Fe2+,其操作正确的顺序是( )
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A.①② B.②③ C.①②③ D.③②
19.在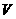 L Al2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得白色固体
L Al2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得白色固体 g,则溶液中SO
g,则溶液中SO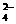 的物质的量浓度是( )
的物质的量浓度是( )
A.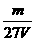 mol·L-1 B.
mol·L-1 B.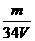 mol·L-1
mol·L-1
C.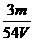 mol·L-1 D.
mol·L-1 D. mol·L-1
mol·L-1
18.有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后所需盐酸溶液的体积是( )
A.甲=丙>乙 B.丙>乙>甲 C.乙>甲=丙 D.甲=乙=丙
17.下列有关Na2CO3和NaHCO3性质的比较中,正确的是( )
A.热稳定性:Na2CO3<NaHCO3
B.与稀盐酸反应的快慢:Na2CO3>NaHCO3
C.106g Na2CO3和84g NaHCO3分别与过量的盐酸反应,放出CO2的质量:Na2CO3>NaHCO3
D.常温时水溶性:Na2CO3>NaHCO3
16.在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
A.Fe2+ B.Fe3+ 和Fe2+ C.Cu2+ 和Fe2+ D.Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com