
题目列表(包括答案和解析)
7、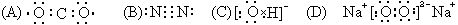 下列电子式书写错误的是( ).
下列电子式书写错误的是( ).
6、在周期表中,第三、四、五、六周期元素的数目分别是( )
A、8、18、32、32 B、8、18、18、32
C、8、18、18、18 D、8、8、18、18
5、 原子的核外电子数( )
原子的核外电子数( )
A.大于 B.小于 C.等于 D.不能肯定
4、已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是
A、X的能量一定低于M的,Y的能量一定低于N的
B、因为该反应为吸热反应,故一定要加热反应才能进行
C、破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D、反应物X和Y的总能量一定大于生成物M和N的总能量
3、下列性质中,可证明某化合物内一定存在离子键的是( )
A、可溶于水 B、具有较高的熔点 C、水溶液能导电 D、熔融状态能导电
2、下列各组微粒,半径之比大于1的是( )
A、Na+/Na B、Mg/Na C、Cl-/Cl D、P/Si
1、质量数为37的原子应该有( )
A、18个质子、19个中子、19个电子
B、17个质子、20个中子、18个电子
C、19个质子、18个中子、20个电子
D、18个质子、19个中子、18个电子
21.(8分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)被还原的HNO3的物质的量为 mol;标准状况下产生NO的体积为 L。
(2)将产生的气体全部释放后,向溶液中加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液全部转化为NaNO3,至少需要30%的双氧水 g。
20. (8分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g);正反应放热。当反应进行到时间t1时达到平衡,测得混合气体总物质的量为2.1mol。试回答下列问题:
(8分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g);正反应放热。当反应进行到时间t1时达到平衡,测得混合气体总物质的量为2.1mol。试回答下列问题:
(1)反应进行到t1时 ,SO2的体积分数为 。
(2)若在t1时充入一定量的氩气,SO2物质的量将 (填“增大”、“减小”、或“不变”)。
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量 2.1mol(填“〈”、“〉”、或“=”),并简单说明原因 。
19.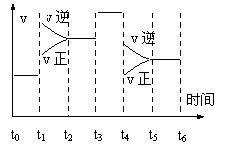 (10分)一密闭容器中发生下列反应N2+3H2
(10分)一密闭容器中发生下列反应N2+3H2 2NH3;正反应放热。下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
2NH3;正反应放热。下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
(1)处于平衡状态的时间段是_______ _____
(2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?__________ 、__________、 ___________。
(3)下列时间段中,氨的百分含量最高的是
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com