
题目列表(包括答案和解析)
1.我国的“神州六号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是 ( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
27、在盛有500mL0.1mol/LCuSO4和0.4mol/LH2SO4混合溶液的大烧杯中。用锌、铜作电极,用导线连接形成原电池,当电极锌消耗6.5g时,试完成:(提示:在原电池反应中,Cu2+的氧化性比H+的氧化性要强)
(1)写出电极反应式:负极__________________;正极_______________________________。
(2)电极上共析出氢气的质量。
高一化学备课组
26、(1)高中老教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3gNaHCO3或Na2CO3粉末的小气球分别套在两支试管口(如右图)。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
①I试管和II试管中分别发生的离子方程式:
_____________________________________________________;
_____________________________________________________;
②两支试管中的现象(填产生沉淀或气体及反应速率等相关现象)
____________________________________________________________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲下结论的方法是否正确?____________________(填正确或不正确)。
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前 温度 |
混合后最高 或最低温度 |
|
① |
50mL水 |
2.5gNaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2gNa2CO3固体 |
20℃ |
23.3℃ |
|
③ |
35mL稀盐酸 |
含2.5gNaHCO3的饱和溶液15mL |
20℃ |
18.8℃ |
|
④ |
50mL稀盐酸 |
含3.2gNa2CO3饱和溶液15mL |
20℃ |
21.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
17.4℃ |
|
⑥ |
50mL稀盐酸 |
3.2gNa2CO3固体 |
20℃ |
24.4℃ |
请你帮助填写相关内容:
①该研究报告的题目是《______________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、环形玻璃搅拌棒、胶头滴管、烧杯、量筒、保温瓶外,还需要的仪器名称为__________和___________;通过上述实验可得出三条结论:
a:NaHCO3的溶解是_________________________(吸热或放热)过程;
b:Na2CO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应;
c:NaHCO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应。
25、(6分)工业上合成氨的化学反应方程式为:N2+3H2 2NH3。在某条件下,将2molN2和6molH2通入一容积为2L的密闭容器中,在催化剂存在时进行反应。2min后测得N2的物质的量为1.2mol,则在这2min内,以N2的浓度变化表示的平均反应速率为__________;同一时间内生成的NH3的物质的量为________,以NH3的浓度变化表示的平均反应速率为_____________,同理也可以算出以H2的浓度变化表示的平均反应速率。对比分别以N2、H2、NH3的浓度变化表示的反应速率数值,可以得出的结论是___ _
_______。
2NH3。在某条件下,将2molN2和6molH2通入一容积为2L的密闭容器中,在催化剂存在时进行反应。2min后测得N2的物质的量为1.2mol,则在这2min内,以N2的浓度变化表示的平均反应速率为__________;同一时间内生成的NH3的物质的量为________,以NH3的浓度变化表示的平均反应速率为_____________,同理也可以算出以H2的浓度变化表示的平均反应速率。对比分别以N2、H2、NH3的浓度变化表示的反应速率数值,可以得出的结论是___ _
_______。
24、(4分)用电子式表示下列物质的形成过程:
N2:_____________________________________________________________________
K2S:_____________________________________________________________________
23、(5分)a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数 |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中,b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;c与f可形成两个共价型的g分子。
(1)A微粒的核外电子排布结构示意图为 。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱相比较为 > 。
(3)d溶于水的电离方程式为 。
22、(4分)以下列出了四种物质的分子结构示意图。其中圆圈表示原子核以及包含除价电子以外的电子的示意图,黑点表示非共用电子对,直线表示共价键,且图中各分子仅是由一、二周期元素的原子构成的。在括号里填写四种物质的分子式。
(1) (2)
(2)

(3) 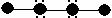 (4)
(4) 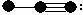
21、(10分)下表标出的是元素周期表的一部分元素,回答下列问题:

(1)表中用字母标出的15种元素中,化学性质最不活泼的是 (用元素符号表示,下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)
(2)B,F,C气态氢化物的化学式分别为 ,其中以 最不稳定。
(3)第三周期中原子半径最小的是 。
20、下列说法中正确的是( )
A、物质发生化学反应都伴随着能量变化
B、伴有能量变化的物质变化都是化学变化
C、在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同
D、在一个确定的化学反应关系中,反应物的总能量高于生成物的总能量
第二卷 非选择题(共48分)
18、下列微粒中,与NH4+的质子数和电子数都相同的是( )
|
|
 19、镍氢电池的总反应式是 H2+2NiO(OH) 2Ni(OH) 2,根据此反应式判断,此电池放电时,负极上发生反应的物质是
19、镍氢电池的总反应式是 H2+2NiO(OH) 2Ni(OH) 2,根据此反应式判断,此电池放电时,负极上发生反应的物质是
A、NiO(OH) B、Ni(OH) 2 C、H2 D、H2和NiO(OH)、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com