
题目列表(包括答案和解析)
3、俗称苏打的物质是 ( )
A、NaHCO3 B、Na2CO3 C、Na2SO4 D、Na2S2O3
2、医用的生理盐水的浓度是 ( )
A、75% B、35%--40% C、3%--5% D、0.9%
1、钠在自然界里存在的主要形式 ( )
A、单质 B、氧化钠 C、氢氧化钠 D、氯化钠
28.(4分)由第ⅡA族金属单质A和第ⅢA族金属单质B组成的混合物1.29g ,用过量的盐酸其完全溶解后生成的氢气在标况下的体积为1.456L.若A和B的原子量之比为8:9,混合物中A和B的原子个数比为2:3,求A、B的的相对原子质量。
|
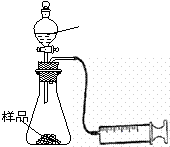
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行)
(3)打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为VmL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x+y=VmL/22400mL·mol-1,他们依据的原理是_________。根据相似原理,请完成下列算式:2x+y=__________由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
14班附加题
(本题10分)已知Cl2和NO2在一定条件下可以化合成一种气态化合物A。为了测定A的组成进行如下实验:
(1)(2分)当Cl2与NO2混合气体以不同比例混合时,测得其平均相对分子质量分别为51和61,分别求出Cl2在上述混合气体中的体积分数 、 。
(2)(2分)取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,由此写出Cl2和NO2反应的化学方程式 。
(3)(4分)设Cl2的体积分数为x(0<x<1),试讨论当x的取值不同时(Cl2与NO2的总体积为5L),反应后的总体积V随x变化的函数关系,将结果填入下表(可以不填满)
|
X值 |
V(反应后混合气体体积) |
|
|
|
|
|
|
|
|
|
(4)(2分)请在下图中画出反应后的总体积V随x变化的函数图象。
27、(4分)a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数 |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中,b的离子半径大于e的离子半径;d是由共价键构成的四原子分子;c与f可形成两个共价型的g分子。
(1)a微粒的结构示意图为 。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱相比较为 > 。
(3)f的电子式为 。
26.(6分)
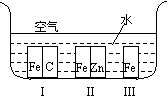 (1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
(2)氟氯代烷是一种能破坏臭氧层的物质。在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:
①Cl+O3→ClO+O2 ②O3→O+O2 ③ClO+O→Cl+O2
上列的反应的总反应式是________________________,少量氟氯代烷能破坏大量臭氧的原因是___________________________________。
25. (4分)写出下列物质的结构式
氮气_____________________________二氧化碳______________________________
氨气_____________________________甲烷___________________________________
24、(4分)推断下列化合物的化学式:
(1)第三周期内,A、B两元素的原子序数之差为4,它们组成的化合物AB,其化学式为______.
(2)1mol某物质含有不同周期的三种元素原子各1mol,其核电荷总数为20mol,该物质的化学式为______.
(3)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则X和Y所形成的化合物是______.
(4)某非金属X的最高正价为+m,它的最高正价氧化物对应的水化物形成的酸中有b个氧原子,则这种酸的化学式是________.
23、(10分)下图是元素周期表的一部分,表中的①~⑩中元素,回答下列填空:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
二 |
|
|
|
|
① |
|
② |
|
|
三 |
③ |
④ |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
|
四 |
⑨ |
|
|
|
|
|
⑩ |
|
⑴ 在这些元素中,化学性质最不活泼的原子的原子结构示意图为 ___________________
⑵ 除⑧外原子半径最大的元素是 _________,(填元素符号)非金属性最强的元素是_____________(填元素符号)
⑶写出①⑦对应两种元素的符号分别为______、_____,元素③⑤的最高价氧化物对应的水化物相互反应的离子方程式为____________________________
⑷用电子式表示②与④组成化合物的形成过程________________________________ 。
⑸这些元素中的最高价氧化物对应的水化物中,酸性最强的是(填对应化合物的化学式,下同)___________,碱性最强的是________________,呈两性的氢氧化物是 ________________。
22、(4分)以石墨棒为两极,氯化铜溶液为电解液组成的电解池的
阴极电极反应式是
阳极电极反应式是
电解反应的化学方程式为____________________________
在化学反应中发生的能量转变形式是_________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com