
题目列表(包括答案和解析)
20、(5分)书写电子式或用电子式回答下列问题
①NaOH ②H2O ③N2
④以氯化氢为例表示共价键形成 (2分)
⑤以氯化钠为例表示离子键形成 (2分)
19、(5分)比较下列性质
①Br与S 非金属性 ②Be与Mg 金属性
③Mg(OH)2与Al(OH)3 碱性
④H2S与HI 还原性
⑤H3PO4与H2SO4 酸性
18、(13分)根据提供条件推断元素,并按要求填空:
①原子核外有3个电子层,其价电子数为7,最高价氧化物化学式 ,最高价氧化物对应水化物化学式 ,其单质与NaOH反应的化学方程式为 (2分)。
②短周期金属元素,最外层电子数与电子层数相同。最高价氧化物与强酸反应的离子方程式为 (2分),最高价氧化物对应水化物与强碱反应的化学方程式为 (2分)。
③原子最外层电子数为电子层数三倍的非金属元素,与氢元素组成的化合物有两种,其化学式分别为 、 ,其单质也有两种,化学式分别为 、 。
④原子序数依次递增的四种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为 、 、 、 。
17、(4分)在周期表主族元素中,甲元素与乙、丙、丁三元素上下或左右紧密相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数,这四种元素原子的最外层电子数之和为20个。
据此可以判断:
①甲为 元素,丙为 元素;
②元素乙和丁所形成化合物的分子式为 或 。
16、(4分)有下列四种微粒:①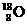 、②
、② 、③
、③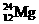 、④
、④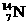 。
。
试用①、②、③、④回答:
(1)按原子半径由大到小顺序排列的是 。
(2)微粒中质子数小于中子数的是 。
(3)在化合物中呈现的化合价的数值最高的是 。
(4)能形成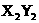 型化合物的是 ,能形成
型化合物的是 ,能形成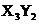 型化合物的是 。
型化合物的是 。
15、元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。请你在元素大厦中为119号元素安排好它的房间( )
A.第八周期第IA族 B.第七周期第 ⅦA族
C.第七周期第0族 D.第六周期第ⅡA族
14、X元素的阳离子与Y元素的阴离子具有与氩原子相同的电子层结构。下列叙述中,正确的是( )
A.X的原子序数比Y要小 B.X的原子最外层电子数比Y大
C.X的原子半径比Y的大 D.X元素的最高正价比Y小
13、某元素X所形成的分子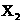 共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7。则下列结论正确的是( )
共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7。则下列结论正确的是( )
A.X有三种同位素
B.其中一种同位素的原子质量数为80
C.质量数为79的同位素,其原子质量分数为50%
D.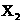 的平均相对分子质量为159
的平均相对分子质量为159
12、某元素形成气态氢化物为 ,其最高价化物水化物的分子中有m个氧原子,则其最高氧化物水化物的化学式( )
,其最高价化物水化物的分子中有m个氧原子,则其最高氧化物水化物的化学式( )
A.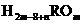 B.
B.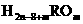 C.
C.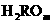 D.
D.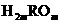
11、下列分子的电子式书写正确的是( )

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com