
题目列表(包括答案和解析)
5、注意以下几种情况
(1)在有H+存在的情况下,MnO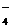 、ClO-、NO
、ClO-、NO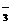 的氧化性会增强。如Fe2+、Na+、NO
的氧化性会增强。如Fe2+、Na+、NO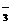 可以共存;但Fe2+、H+、NO
可以共存;但Fe2+、H+、NO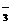 不能共存,Fe2+被氧化成Fe3+。
不能共存,Fe2+被氧化成Fe3+。
(2)Fe2+与Fe3+可以共存,因为它们之间不存在中间价态。
(3)Fe3+不能氧化Cl-。NO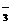 (有H+时)不能氧化Cl-.
(有H+时)不能氧化Cl-.
(4)还应注意题目是否给出溶液的酸碱性,是否给定溶液是无色的。在酸性溶液中除题给离子外,还应有大量H+;在碱性溶液中除题给离子外,还应有大量OH-。若给定溶液为无色时,则应排除Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO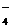 (紫色)。
(紫色)。
4、离子之间能发生氧化还原反应时,则这些离子不能大量共存。一般说来,有氧化性的离子(如MnO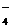 、ClO-、Fe3+、NO
、ClO-、Fe3+、NO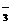 等)与有还原性的离子(如S2-、I-、Br-、SO
等)与有还原性的离子(如S2-、I-、Br-、SO 、Cl-、Fe2+等)不能大量共存。
、Cl-、Fe2+等)不能大量共存。
4、书写离子方程式时应注意的几个问题
(1)注意哪些物质是难溶于水的物质,哪些物质是易溶于水的,哪些物质是微溶于水的。
在写离子方程式时难溶于水的物质必须用分子式表示,不能写成离子形式。
对于微溶物的处理,有以下三种情况:
①在生成物中有微溶物析出时,应用分子式表示。如Na2SO4浓溶液与CaCl2浓溶液反应时,其离子方程式为: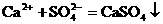
②当反应物中有微溶物并且处于澄清状态时,应将微溶物写成离子形式。如在澄清的石灰水中通入适量CO2,其离子方程式为:

③当反应物中有微溶物,且处于悬浊液或固态时,应将微溶物写成分子式。如在石灰乳中加入Na2CO3浓溶液,其离子方程式为:
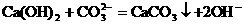
(2)注意哪些物质是强电解质,在溶液中是易电离的;哪些物质是弱电解质,在溶液中是难电离的。
常见的弱电解质有:HF、HClO、H2S、CH3COOH等弱酸;H2SO3、H2PO4等中强酸;NH3·H2O等弱碱;还有水也是弱电解质。
在写离子方程式时,难电离的物质应写成分子式。如醋酸与NaOH溶液反应的离子方程式为: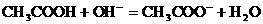 。
。
氢硫酸与硫酸铜溶液反应的离子方程式为: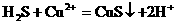 。
。
(3)注意反应是否在溶液中进行。
离子方程式只能用来表示电解质在溶液中进行的反应,不是在溶液中进行的反应,一般不用离子方程式表示。如氯化铵固体与熟石灰固体之间经加热生成氨气的反应,就不能用离子方程式表示,只能用化学方程式表示:
2NH4Cl+Ca(OH)2 CaCl2+2NH3
CaCl2+2NH3 +2H2O
+2H2O
而NH4Cl溶液与NaOH溶液混合加热的反应,就可以用离子方程式表示:
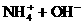


(4)注意浓酸中水的含量
浓H2SO4的浓度一般为98%,水的含量很少,其溶质基本上以硫酸分子的形式存在,所以有浓硫酸参加的一些反应,可以认为不是在溶液中进行的反应。如NaCl固体与浓硫酸、Cu与浓硫酸的反应,一般不用离子方程式表示,只能用化学方程式表示:
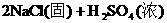

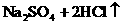
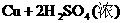

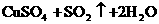
浓盐酸的浓度一般为36%,浓硝酸的浓度一般为69%,它们溶液中的溶质几乎完全以离子形式存在,所以在离子方程式中,浓HCl与浓HNO3都应写成离子形式。如:
MnO2与浓盐酸共热制取Cl2的离子方程式为:
MnO2
+ 4H+ + 2Cl- Mn2+ + Cl2
Mn2+ + Cl2 + 2H2O
+ 2H2O
Cu与浓硝酸反应的离子方程式为:
Cu
+ 4H+ + 2NO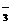 =Cu2+ + 2NO2
=Cu2+ + 2NO2 + 2H2O
+ 2H2O
Cu与稀硝酸反应的离子方程式为:
3Cu
+ 8H+ + 2NO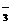 =3Cu2++2NO
=3Cu2++2NO +4H2O
+4H2O
(5)注意电荷是否守恒
一个正确的离子方程式,不仅要遵循质量守恒,还要遵循电荷守恒。即反应前后各元素的原子个数要相等,方程式两边离子所带电荷也应相等。如Cl2与FeBr2反应的离子方程式,若写成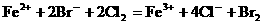 就错了。虽然反应前后各元素原子个数相等,但两边电荷数不等,因而是错误的。正确的写法是:
就错了。虽然反应前后各元素原子个数相等,但两边电荷数不等,因而是错误的。正确的写法是:
2Fe2+ +4Br-+3Cl2=2Fe3++6Cl-+2Br2。
(6)注意溶液中溶质电离出的阴离子和阳离子配比数是否正确
有些离子方程式中离子数不能任意约减,要注意电解质电离时阴、阳离子的配比。如:H2SO4与Ba(OH)2溶液反应的离子方程式,应当是
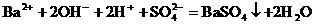
而不应写成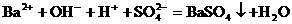 ,因为Ba(OH)2 电离时,电离出的
,因为Ba(OH)2 电离时,电离出的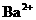 与
与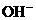 物质的量之比为1∶2而不是1∶1;H2SO4电离出的H+与SO
物质的量之比为1∶2而不是1∶1;H2SO4电离出的H+与SO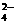 物质的量之比为2∶1而不是1∶1。
物质的量之比为2∶1而不是1∶1。
(7)注意有水参加的反应
在许多离子反应中,水是一种反应物,书写离子方程式时一定要注意这一隐含因素。如Ca(ClO)2溶液中通入CO2的离子方程式为:
Ca2++2ClO-+CO2+H2O
= CaCO3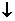 +2HClO
+2HClO
又如往溴水中通入SO2气的离子方程式为:
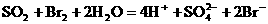
5、判断离子方程式正误的主要内容
(1)看反应能否写离子方程式。
(2)看“==”、“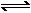 ”、“
”、“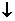 ”、“
”、“ ”及必要的反应条件是否正确、齐全。
”及必要的反应条件是否正确、齐全。
(3)看表示各物质的化学式是否正确。如HCO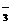 不能写成H++CO
不能写成H++CO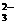 ,而HSO
,而HSO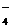 通常应写成H++SO
通常应写成H++SO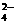 等。该用离子表示的是否拆成了离子,该用分子式表示的是否写成了分子式。
等。该用离子表示的是否拆成了离子,该用分子式表示的是否写成了分子式。
(4)看产物是否符合事实。如H2S与FeCl3反应生成FeCl2、S和HCl,而不生成FeS。
(5)看是否漏掉离子反应。如Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+与SO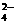 生成BaSO4的反应,又不能漏掉Cu2+与OH-生成Cu(OH)2的反应。
生成BaSO4的反应,又不能漏掉Cu2+与OH-生成Cu(OH)2的反应。
此外,还要检查是否符合质量守恒、电荷守恒;检查反应物或生成物的配比是否正确。
(三)关于溶液中离子共存问题
在溶液中离子共存问题的实质是哪些离子之间不能发生反应。能够发生反应的离子就不能共存,不能发生反应的离子才可以共存。
1、在溶液中某些离子间能互相反应生成难溶性物质时,这些离子就不能大量共存。如SO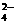 与Ba2+、Pb2+、Ag+;OH-与Cu2+、Fe3+、Mg3+、Al3+、Zn2+;Ag+与Cl-、Br-、I-、CO
与Ba2+、Pb2+、Ag+;OH-与Cu2+、Fe3+、Mg3+、Al3+、Zn2+;Ag+与Cl-、Br-、I-、CO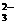 、SO
、SO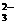 、S2-;Mg2+、Ca2+、Ba2+2+2+2+222+、与CO
、S2-;Mg2+、Ca2+、Ba2+2+2+2+222+、与CO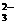 、SO
、SO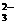 、PO
、PO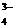 ;S2-与Cu2+、Pb2+等,不能大量共存。
;S2-与Cu2+、Pb2+等,不能大量共存。
2、离子间能结合生成难电离物质时,则这些离子不能大量共存。如H+与、OH-、ClO-、CH3COO-、HPO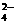 、H2PO
、H2PO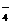 ;OH-与HCO
;OH-与HCO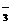 、HS-、HSO
、HS-、HSO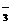 、H2PO
、H2PO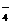 、HPO
、HPO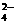 、H+等不能大量共存。
、H+等不能大量共存。
3、离子间能结合生成挥发性物质时,则这些离子不能大量共存。如H+与CO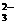 、SO
、SO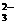 、HCO
、HCO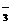 、HSO
、HSO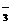 、S2-、HS-;OH-与NH
、S2-、HS-;OH-与NH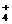 等不能大量共存。
等不能大量共存。
3、书写离子方程式的四个步骤
(1)写--根据客观事实,写出正确的化学方程式。
(2)拆--把易溶于水且易电离的物质写成离子形式,把难溶于水的物质或难电离的物质以及气体、单质、氧化物仍用分子式表示。对于难溶于水但易溶于酸的物质,如CaCO3、FeS、Cu(OH)2、Mg(OH)2等仍写成分子式。
(3)消--对方程式的两边都有的相同离子,把其中不参加反应的离子,应“按数”消掉。
(4)查--检查写出的离子方程式是否符合前三项的要求,并检查是否符合质量守恒、是否符合电荷守恒。
2、离子方程式的特点
离子方程式不仅表示一定物质间的某个反应,而且还表示所有同一类型的离子反应。如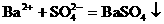 ,不仅表示BaCl2溶液与Na2SO4溶液之间的反应,还表示所有可溶性钡盐与可溶性硫酸盐溶液的反应。
,不仅表示BaCl2溶液与Na2SO4溶液之间的反应,还表示所有可溶性钡盐与可溶性硫酸盐溶液的反应。
1、离子方程式的概念
用实际参加反应的离子符号来表示离子反应的式子叫做离子方程式。
3、离子反应的类型
(1)离子互换反应 在溶液中酸、碱、盐之间互相交换离子的反应,一般为非氧化还原反应。
(2)离子互换反应发生的条件
①生成难溶的物质。如生成BaSO4、AgCl、CaCO3等。
②生成难电离的物质。如生成CH3COOH、H2O、NH3·H2O、HClO等。
③生成挥发性物质。如生成CO2、SO2、H2S等。
只要具备上述三个条件中的一个,离子互换反应即可发生。这是由于溶液中离子间相互作用生成难溶物质、难电离物质、易挥发物质时,都可使溶液中某几种、自由移动离子浓度减小的缘故。若不能使某几种自由移动离子浓度减小时,则该离子反应不能发生。如KNO3溶液与NaCl溶液混合后,因无难溶物质、难电离物质、易挥发物质生成,Na+、 Cl-、K+、NO 浓度都不减少,四种离子共存于溶液中,故不能发生离子反应。
浓度都不减少,四种离子共存于溶液中,故不能发生离子反应。
(3)有离子参加的氧化还原反应
①置换反应的离子反应 金属单质与金属阳离子之间的置换反应,如Fe与CuSO4溶液的反应,实际上是Fe与Cu2+之间的置换反应。非金属单质与非金属阴离子之间的置换反应,如Cl2与NaBr溶液的反应,实际上是Cl2与Br-之间的置换反应。
②其它一些有离子参加的氧化还原反应 如MnO2与浓HCl反应制取Cl2;Cu与FeCl3溶液反应生成FeCl2、CuCl2;Cl2与NaOH溶液反应生成NaCl、NaClO和水等。
这些离子反应发生的条件是:比较强的氧化剂和较强的还原剂反应,生成氧化性较弱的氧化产物和还原性较弱的还原产物。因此掌握一些常见离子的氧化性或还原性的相对强弱,是判断这一类离子反应能否发生的重要依据。
2、离子反应的特点
离子反应的反应速率快,相应离子间的反应不受其它离子的干扰。
1、离子反应的概念
在反应中有离子参加或有离子生成的反应称为离子反应。在中学阶段仅限于在溶液中进行的反应,可以说离子反应是指在水溶液中有电解质参加的一类反应。因为电解质在水溶液里发生的反应,其实质是该电解质电离出的离子在水溶液中的反应。
26.(6分)一块表面已被氧化成氧化钠的钠块质量为1.08克,投入到100 克水中完全反应后收集到0.02克氢气,求:
(1) 未被氧化的金属钠的质量是多少克?
(2) 所得溶液中溶质的质量分数是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com