
题目列表(包括答案和解析)
6.对于X-O-H型化合物而言,X是除H、O外的其他元素时,下列说法中正确的是( )
A.当X是活泼金属时,它一定是强碱
B.当X是非金属性很强的元素时,X-O-H一定是强酸
C.X-O-H的水溶液不能导电
D.X-O-H一定是共价化合物
5.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族, 称为类铅元素.下面关于它的原子结构和性质预测正确的是( )
A.类铅元素原子的最外层电子数为4 B.其常见价态为+2、+3、+4
C.它的金属性比铅强 D.它的原子半径比铅小
4.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A.A、B、C、D、E B.E、C、D、B、A C.B、A、D、C、E D.C、D、A、B、E
3.X、Y、Z代表三个不同的短周期元素.X元素的原子最外层只有一个电子;Y元素在周期表 中位于第三周期,与磷元素相邻;Z原子的L电子层有6个电子,由这三种元素组成化合物的化学式可能是( )
A.X3YZ4 B.X4YZ4 C.XYZ2 D.X2YZ4
2.某元素在自然界里由两种同位素组成,其原子个数比为2.44∶1.05,第一种同位素的原 子 核内有29个质子和34个中子,第二种同位素原子核中的中子数比第一种多2个,该元素的平均原子量是( )
A.64.00 B.63.60 C.65.00 D.63.00
1.据报载我国最近合成多种元素的新的同位素,其中一种是18572Hf(铪),它的中子数是( )
A.72 B.113 C.185 D.257
25.在25℃时向100ml含HCl 14.6g的盐酸溶液里放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末收集到H21.12L(标况),在此之后又经过4min,铁粉完全溶解 ,则
① 在前2min内用FeCl2表示的平均反应速率是多少?
② 在后4min内用HCl表示的平均反应速率是多少?
③ 在前2min与后4min相比,反应速率哪个较快?为什么?
24. 已知实验室制取H2S气体的原理是:FeS+H2SO? FeSO4+H2S.根据
下图中A-D的实验装置和试剂进行实验,回答下列问题:
已知实验室制取H2S气体的原理是:FeS+H2SO? FeSO4+H2S.根据
下图中A-D的实验装置和试剂进行实验,回答下列问题:
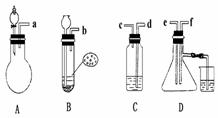 (1)装置A是由双孔塞、玻璃导管及
和
组装起来的.
(1)装置A是由双孔塞、玻璃导管及
和
组装起来的.
(2)组装一套制取SO2气体的装置,并证明SO2既有氧化性,又有还原性.
①按实验装置连接顺序,把a f各导管口连接起来,正确的顺序是 ,连 , 连 ;
f各导管口连接起来,正确的顺序是 ,连 , 连 ;
②C装置中的溶液是 ,反应后该溶液变为无色,说明SO2具有 性;
③D中产生的现象是 ,说明SO2具有 性;
(3)A装置中发生反应的化学方程式为 .
(4)烧杯中NaOH溶液的作用 .
23. 工业上将硫磺混入Na2SO3溶液中共热至沸可制取Na2S2O3;Na2SO3+S Na2S2O3.制备硫代硫酸钠的另一种方法是:把SO2通入Na2S和Na2CO3的混合溶液中,在反应过程中,先生成黄色沉淀,其量逐渐增多,然后又逐渐减少,当
形成无色透明溶液时,反应完成.
工业上将硫磺混入Na2SO3溶液中共热至沸可制取Na2S2O3;Na2SO3+S Na2S2O3.制备硫代硫酸钠的另一种方法是:把SO2通入Na2S和Na2CO3的混合溶液中,在反应过程中,先生成黄色沉淀,其量逐渐增多,然后又逐渐减少,当
形成无色透明溶液时,反应完成.
(1)写出用上述反应制备Na2S2O3的化学方程式:① ,② ,
 ③
,④Na2SO3+S Na2S2O3;
③
,④Na2SO3+S Na2S2O3;
(2)原料中Na2CO3、Na2S和SO2的物质的量之比最好是 ;
(3)若SO2过量,则又会有浅黄色沉淀出现,其原因是(用化学方程式表示) .
22.固体A、B都由两种相同元素组成,A、B中两种元素的原子个数比为1∶1和1∶2.将A、B高温煅烧,产物都是固体C和气体D,由D最终可制得强酸E,E的浓溶液和铜片在加热条件下反应生成气体D.E的稀溶液和A反应时,生成气体G和溶液F,G通入D的水溶液中,有浅黄色沉 淀生成.在F中滴入溴水后,加入KOH溶液有红褐色的沉淀生成,该沉淀加热时能转变为C,根据上述事实回答:
(1)A、B的化学式分别为 , .
(2)写出下列反应的化学方程式:
①A煅烧生成C和D ;
②B煅烧生成C和D ;
③G通入D的溶液中 ;
④在F中滴入溴水 ;
(3)写出A和E反应的离子方程式 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com