
题目列表(包括答案和解析)
14.(1)试管外壁应干燥,有水珠应擦干,试管里的液体不应超过试管容积的l/3。
(2)试管应用试管夹夹持,不能用尹拿着加热以免烫伤手。(试管夹夹持试管的方法是:把试管夹张开,由试管底部套上、取下,不得横套、横出)试管夹应夹在离试管口1/3处。加热时握持试管夹的方法是:右手三指(拇、食、中)握持试管夹长柄。
(3)加热时,应将试管倾斜,以与桌面成45°角为宜。
(4)加热时,应先使整个试管均匀受热,然后小心地在溶液的中下部加热(不要集中烧试管底部以防溶液喷出),并不断摇动试管,保持试管在灯焰内缓缓转动。
(5)试管底部应位于酒精灯的外焰部分(外焰温度最高),加热时不能使试管底部跟灯芯接触(因灯芯温度较低,较热的试管底部突然冷却容易炸裂)。
(6)试管口不要对着自己或别人,更不能把眼睛对着正在加热的试管口张望。
13.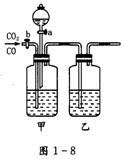 见图1-8将混合气体通过浓NaOH,进行洗气,则先将CO2吸收,将剩余的CO气体通过浓H2SO4即得到干燥的CO。再将盐酸滴入洗气瓶中将CO2放出,并通过浓硫酸进行干燥,即得到干燥的CO2。
见图1-8将混合气体通过浓NaOH,进行洗气,则先将CO2吸收,将剩余的CO气体通过浓H2SO4即得到干燥的CO。再将盐酸滴入洗气瓶中将CO2放出,并通过浓硫酸进行干燥,即得到干燥的CO2。
解析:要将CO2和CO分离并得到干燥的气体,可根据两种气体化学性质上的差异,选择适当的吸收剂,先将一种气体吸收,将另一种气体干燥,然后再将吸收的气体放出并进行干燥。所以,应先用浓NaOH将CO2吸收,生成Na2CO3。将不溶于NaOH的CO通过浓H2SO4干燥得到干燥的CO。再将盐酸滴入Na2CO3中,将生成的CO2通过浓硫酸干燥,从而得到干燥的CO2。
12.(1)蒸发皿坩埚
(2)改用Ba(NO3)2会使溶液中引入新的杂质离子NO ,以后操作中无法除去
,以后操作中无法除去
(3)取上层清液加入BaCl2溶液,若无沉淀说明SO 已除尽
已除尽
(4)除去过量的Ba2+减少一次过滤操作
(5)除去溶解在溶液中的CO2
11。(1)将混合物滴入盐酸后过滤(CuO+2HCl====CuCl2+H2O)。
(2)将滤液加入NaOH溶液生成沉淀滤出(CuCl2+2NaOH====Cu(OH)2↓+2NaCl)。
(3)将滤渣加热即得到CuO(Cu(OH)2 CuO+H2O)。
CuO+H2O)。
解析:根据各组分的性质不同,CuO能溶于盐酸而铜粉不能即可进行分离。
10.B 解析:萃取操作也应在烧杯中进行,然后转移到分液漏斗中分液;取用药品要适量,不要再放回原试剂瓶,否则会使整瓶药剂被污染而失效或不纯,应放在指定的容器内以备其他用途;称量物质时应先取大砝码放在托盘天平右盘中央,根据天平倾斜情况添加或换较小砝码,若先放小砝码,在称量时砝码的增减次数将会多得多,浪费时间。
9.C 解析:漏斗可用于过滤,分离固、液混合物,蒸馏烧瓶可用于蒸馏或分馏,分离固、液混合物或液、液混合物,分液漏斗用于分液,分离互不相溶的两种液体混合物。
8.CD 解析:了解了各个实验步骤的目的,才能分清操作顺序。加入过量的NaOH溶液的目的是除去Mg2+,加入过量BaCl2溶液是为了除去SO ;加入过量的Na2CO3溶液是为除去Ca2+及多余的Ba2+,然后进行过滤,除去Mg(OH)2、BaSO4、CaCO3、BaCO3等难溶物,然后加适量的盐酸,除去多余的CO
;加入过量的Na2CO3溶液是为除去Ca2+及多余的Ba2+,然后进行过滤,除去Mg(OH)2、BaSO4、CaCO3、BaCO3等难溶物,然后加适量的盐酸,除去多余的CO 和调节溶液的pH。
和调节溶液的pH。
7.A 解析:提纯物质要注意三条:①最好不引入新的杂质;②不能减少被提纯物质的质量;③实验操作要简便、易行。Na2CO3、石灰水、氨水都能与CO2反应:
NaCO3+CO2+H2O====2NaHCO3
Ca(OH)2+CO2====CaCO3↓+H2O
2NH3·H2O+CO2====(NH4)2CO3十H2O
只有NaHCO3不与CO2反应,但能与HCl反应,转变为CO2。所以应将混合气体通过饱和NaHCO3溶液。
6.C 解析:用分液漏斗分液时,若上层液体也从下口流出,将导致所得上层液体不纯净,仍然混有下层液体成分,温度计用于蒸馏时,测量的是蒸气的温度,因此,水银球部分不应靠近蒸馏烧瓶支管口,只有在测量液体或反应液温度时,水银球部分才插入液面以下,蒸发结晶时不应将溶液蒸干,应在出现大量晶体时停止加热,利用余热将溶液蒸干。用托盘天平称量的原则是:“左物右码”,被称量物不能直接放在托盘上。
5.B 解析:利用本题检查对蒸发、结晶操作的掌握情况。蒸发、结晶是在蒸发皿中进行的。根据蒸发、结晶的操作过程不难作出正确的判断。蒸发过程中先放置酒精灯,然后固定铁圈的位置,再放上蒸发皿即可进行蒸发了。蒸发过程中要用玻璃棒不停地进行搅拌,最后蒸干时应利用余热将其蒸干。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com