
题目列表(包括答案和解析)
2.(10分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
高一下期第一次双月考化学试题
1.(10分)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出.
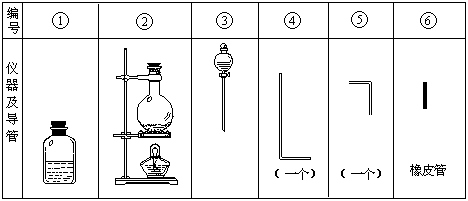 进行此实验,所用的仪器及导管如图.
进行此实验,所用的仪器及导管如图.
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是 .
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是 .
(3)仪器①的橡皮塞上应有 个孔,原因是 .
(4)实验时,仪器①中除观察到红光外还有 现象.
(5)实验需用约10%H2O2溶液100毫升,现用市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是 .
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是 .
34.(4分)
选作题(共20分)
说明:这一部份习题一般同学可以不做。
33.(7分)某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100t。试计算:
⑴如果煤中的硫全部转化为二氧化硫,每天可以产生二氧化硫的质量是多少吨?
⑵这些二氧化硫在标准状况是多少立方米?

32.(7分)酸性高锰酸钾溶液是一种常用强氧化剂,在化学实验中可用于吸收二氧化硫气体。
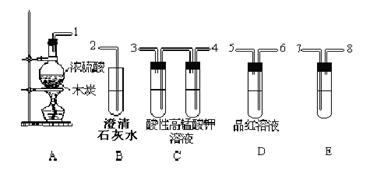 浓H2SO4与炭反应,生成的气体产物用下图装置来确认。
浓H2SO4与炭反应,生成的气体产物用下图装置来确认。
请用仪器间相互联接处的标号,写出联接顺序:
__1___接___7_;_____接____;_____接____;___5__接__2____.
并回答:
(1)E试管中盛放的试剂是 ,作用是 .
(2)D装置的作用是 .
(3)写出A装置中反应的化学方程式 ,
B装置中反应的离子方程式 .
31.(4分) 按指定元素的价态变化,各写一个化学方程式(每个化学方程式只能用一次)

30. (8分)下图是六种物质的相互转化关系.已知E是固态单质,六种物质中均含有构成E的元素.
(8分)下图是六种物质的相互转化关系.已知E是固态单质,六种物质中均含有构成E的元素.
(1) 写出各物质的化学式:
A: B: C:
D: E: F:
(2) 写出①④的化学方程式:
①
④
29.(2分)R2-的M电子层与L电子层的电子数目相等, 元素R应处于周期表的___周期____族.
28.(8分)A、B、C三元素原子的核外电子数都比氩原子少, A和C处于同主族, 两者间隔一周期, A元素和B元素的原子两者核电荷数之差为5, B原子核外第3电子层比第2电子层少两个电子, 则B的原子结构示意图为______;A离子的结构示意图为_____;B与C形成化合物的化学式是_____,它的电子式是 它属于 化合物(填“离子”或“共价”);A与B形成化合物的化学式是 , 它的电子式是 ,它属于 化合物。
27.(6分) 用化学符号表示符合下列条件的微粒:
(1)含有10个电子的分子有: Ne、 HF 、____、 和 CH4 。
(2)含有10个电子的阳离子有: Na+、____、____、 NH4+和 H3O+。
(3)含有10个电子的常见阴离子有:___、____、和 OH-。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com