
题目列表(包括答案和解析)
63.(09娄底)元素周期表是学习和研究化学的重要工具。下表是元素周期表中的一部分,请按表中信息填空:
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
|
2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 9.00 |
10Ne 氖 20.18 |
|
3 |
11Na 钠 22.99 |
12Mg 镁 24.31 |
13 Al 铝 6.98 |
14 Si 硅 8.09 |
15 P 磷 0.97 |
16 S 硫 2.06 |
17 Cl 氯 5.45 |
18 Ar 氩 39.95 |
(1)查找出原子序数为10的元素名称 25 ,其相对原子质量 26 。
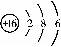
(2)硫元素的原子结构示意图为 .该元素的原子核外有 27 个电
子层,它属于 28 元素(填“金属”、“非金属”),其化学性质比较活泼,在化学反应中易 29 (填“得”、“失”)电子。
答案:25 氖 26. 20.18 27 3 28. 非金属 29. 得
62.(09南通)(1)历史上,道尔顿认为,原子是一个个简单的、不可分割的实心球体。现在你认为该观点 ▲ (选填“正确”或“错误”)。

|
示意图分别表示为:
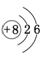
右图是元素周期表的一部分(数字表示相应元
素的原子序数),请用元素符号将两种元素填入表中相应位置。
(3)上表中硫元素的每个原子需要得到 ▲ 个电子形成相对稳定结构的离子,该离子与Na+形成化合物的化学式为 ▲ 。
(4)亚氯酸钠(NaClO2)是一种重要的消毒剂,其中氯元素的化合价为 ▲ 。
答案:(1)错误 (2)O Al (3)2 Na2S (4)+3 每空1分
61.(09南京)从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材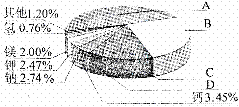 料。请回答-下列问题:
料。请回答-下列问题:
(1)地壳里各种元素的含量(质量分数)如右图所示,其中表示硅元素的是 (填字母)。
(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,则常温下硅的化学性质 (选琐“活泼”、“不活泼”)。
(3)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意如下:
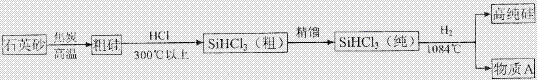
①整个制备过程必须达到无水无氧。在H2还原SiHCl3过程中若混入O2 ,可能引起的后果是 。
②在生产过程中物质A可循环使用,A的化学式是 ;在生产过程中还有一种可循环使用的物质是 。
答案:(1)B (2)不活泼 (3)①硅被氧化得不到高纯硅 引起爆炸 ②HCl 氢气(H2)
60.(09孝感)元素的化学性质主要与原子的 有关;化学变化中不能再分的粒子是 ;地壳中含量最多的元素与空气中含量最多的元素组成的化合物的化学式为 ,其中显正价的元素的化合价为 价。
答案:核外最外层电子数 原子 NO(或NO2……) +2(或+4……)
59.(09宜昌)下图是构成纯净物的粒子间的关系图。请在A、B处填入物质的化学式,C、D处填入粒子名称(填分子、原子或离子)。
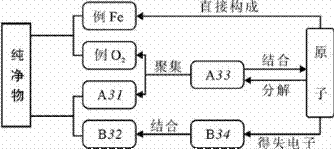
答案:31:CO2或H2O等(只要是分子构成的化合物的化学式均可)32:NaCl(只要是离子构成的化合物的化学式均可)33:分子; 34:离子
58.(09恩施)元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
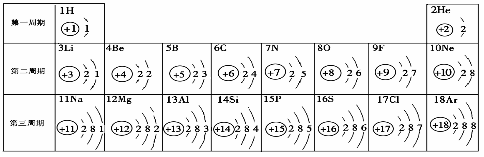
⑴ 第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易________(填“得”或“失”)电子;
⑵ 元素的化学性质与原子结构中的______________数关系密切;
⑶ 在同一族中,各元素的原子结构呈现的规律有________________ (任写一点);
⑷ 研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是 _________________________________。
答案:⑴ 非金属 ;得 ;⑵ 最外层电子 ;⑶ 电子层数递增或最外层电子数相等或从上到下核电荷数增大等(只要合理均可)⑷ 逐渐减小
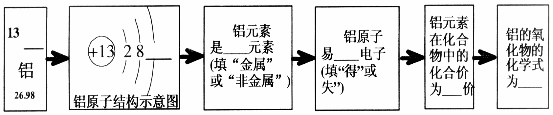
57.(09湛江)元素周期表是同学们学习化学的重要工具。请根据镁元素的“身份证”
(见右图),在下图的横线上填写有关铝元素的6个信息。
56. (09佛山)右图是锂原子的构成示意图,根据图示信息回答下列问题:
(09佛山)右图是锂原子的构成示意图,根据图示信息回答下列问题:
(1)锂元素的原子序数为 ,元素符号为 。
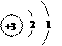
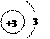
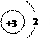
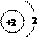 (2)锂原子的结构示意图为
(填字母)。
(2)锂原子的结构示意图为
(填字母)。
|
(3)锂元素与氧元素形成的化合物的化学式为 。
(4)下列对原子构成的理解错误的是 (填字母)。
A.原子整体不显电性 B.原子核比原子小得多
|
答案:(1)3 Li (2)D (3)Li2O (4)C
55.(09临汾)硒元素具有抗衰老、抑制癌细胞生长的功能。在硒的一种化合物硒酸钠Na2SeO4中,硒元素的化合价为 。 答案:+6
54. (09南昌)右图是有关氧气的知识网络图(反应条件部分省略),用化学用语回答:
(09南昌)右图是有关氧气的知识网络图(反应条件部分省略),用化学用语回答:
(1)物质①的化学式是 ;
(2)物质②的阳离子是 ;
(3)物质③带点元素的化合价 ;
(4)生成物质④的化学方程式 。
答案:(1) KMnO4 (2)K+
(3)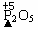 (4) 3Fe+ 2 O2
(4) 3Fe+ 2 O2  Fe3O4
Fe3O4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com