
题目列表(包括答案和解析)
5.11g 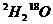 所含的中子的物质的量为:( )
所含的中子的物质的量为:( )
A.4.5mol B.5mol C.5.5mol D.6mol
4.有一种保健食品含有人体所必须的硒元素,有一定的保健作用,已知硒元素与氧元素同族,与钙元素同周期,下列关于硒的描述不正确的是( )
A.原子序数是24 B.最高价氧化物是SeO3,是酸性氧化物
C.原子半径比钙小 D.气态氢化物化学式是H2Se,稳定性比HCl差
3.下列气态氢化物按稳定性由强到弱顺序的是( )
A.HBr、HCl、HF B.HF、H2O、NH3
C.NH3、PH3、H2S D.SiH4、CH4、NH3
2.某元素原子的核外有三个电子层,最外层有4个电子,该原子核内的质子数为( )
A.14 B.15 C.16 D.17
1.下列各组物质中互为同位素的是( )
A.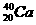 和
和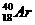 B.D和T
B.D和T C.H2O和H2O2 D.O3和O2
C.H2O和H2O2 D.O3和O2
21、某元素的同位素 ,其氯化物
,其氯化物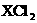 1.1g配成溶液后,需用
1.1g配成溶液后,需用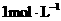 的
的 溶液20mL,才能把氯离子完全沉淀下来。已知同位素中有20个中子。
溶液20mL,才能把氯离子完全沉淀下来。已知同位素中有20个中子。
(1) 计算X的质量数是多少。
(2) 指出X元素在周期表中的位置(周期、族)。
(3)把X的单质放入水中,有何反应现象?滴入的酚酞呈现什么颜色?写出有关的化学方程式。
20、(5分)书写电子式或用电子式回答下列问题
①NaOH ②H2O ③N2
④以氯化氢为例表示共价键形成 (2分)
⑤以氯化钠为例表示离子键形成 (2分)
19、(5分)比较下列性质
①Br与S 非金属性 ②Be与Mg 金属性
③Mg(OH)2与Al(OH)3 碱性
④H2S与HI 还原性
⑤H3PO4与H2SO4 酸性
18、(13分)根据提供条件推断元素,并按要求填空:
①原子核外有3个电子层,其价电子数为7,最高价氧化物化学式 ,最高价氧化物对应水化物化学式 ,其单质与NaOH反应的化学方程式为 (2分)。
②短周期金属元素,最外层电子数与电子层数相同。最高价氧化物与强酸反应的离子方程式为 (2分),最高价氧化物对应水化物与强碱反应的化学方程式为 (2分)。
③原子最外层电子数为电子层数三倍的非金属元素,与氢元素组成的化合物有两种,其化学式分别为 、 ,其单质也有两种,化学式分别为 、 。
④原子序数依次递增的四种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为 、 、 、 。
17、(4分)在周期表主族元素中,甲元素与乙、丙、丁三元素上下或左右紧密相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数,这四种元素原子的最外层电子数之和为20个。
据此可以判断:
①甲为 元素,丙为 元素;
②元素乙和丁所形成化合物的分子式为 或 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com