
题目列表(包括答案和解析)
2.下列各组离子中,因发生氧化还原反应而不能大量共存的是 ( )
A.Fe3+、H+、SO42-、ClO- B.Fe3+、Fe2+、SO42-、NO3-
C.Al3+、Na+、SO42-、CO32- D.K+ 、H+、Cl-、MnO4-
1.氢气是一种绿色能源,科学家们最近研制出利用太阳能产生激光,再用激光分解海水得到氢气的新技术,其中海水分解可以用化学方程式表示为:2H2O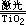 2H2↑+O2↑,据此下列说法不正确的是
( )
2H2↑+O2↑,据此下列说法不正确的是
( )
A.TiO2在反应中作催化剂 B.水分解不产生污染物
C.TiO2在反应中作氧化剂 D.该技术可以将太阳能转化为氢能
17.共8分
(1)Zn + 2H2SO4(浓)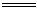 ZnSO4 + SO2↑ + H2O
ZnSO4 + SO2↑ + H2O
1mol 22.4L
n(ZnSO4) 3.36L
则X n(ZnSO4)=0.150mol(1分), c(ZnSO4)=1.50mol·L-1(3分)
(2)据题意:反应后c(H2SO4)为0.0500mol·L-1,n(H2SO4)为0.0500mol
Zn+2H2SO4(浓)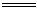 ZnSO4+SO2↑+H2O
ZnSO4+SO2↑+H2O
2n(SO2) n(SO2)
Zn+H2SO4(稀)=ZnSO4+H2↑
n(H2) n(H2)
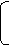 2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1 (4分)
2n(SO2)+n(H2)+0.0500mol=0.100L×18.5mol·L-1 (4分)
n(SO2)+n(H2)= (5分)
解得: n(SO2)=0.300mol(6分) n(H2)=1.20mol(7分)
则:V(SO2)∶V(H2)=0.300mol∶1.20mol=1∶4 (8分)
0.100mol c (HCl) ×0.200L V (H2) 4分
c (HCl)==1.00mol·L-1 6分
(3)V (H2)==2.24L 8分
16.(8分)解:
(1)6.50g锌的物质的量:
n (Zn)==0.100mol 2分
(2) Zn+ 2HCl = ZnCl2+ H2
1mol 2mol 22.4L
15.(共10分)
(1)(共3分,只对两个不得分,从第三个开始每对一个得1分)10 mL量筒、玻璃棒、100 mL容量瓶、胶头滴管、小烧杯
(2)(2分)5 mL
(3)(3分)不准确;(1分)转移完溶液后应用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也一同转入容量瓶中。(2分)
(4)(2分)向容量瓶中注入蒸馏水至离刻度线1~2 cm处,改用胶头滴管滴加蒸馏水到溶液的 凹液面正好与刻度线相切
14.(9分)
(1) 9g 3.01×1023 9.03×1023 (2) CO2 NH3 CO2
(3) 125 2.5 (4) 6︰3︰2(每空1分)
11.BC 12.C 13.D
5.C 6.AD 7.D 8.B 9.AD 10.D
1.BC 2.A 3.C 4.D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com