
题目列表(包括答案和解析)
29、(8分)现有K2SO4和H2SO4的混合溶液100mL。其中K2SO4的浓度为0.5mol/L,H2SO4的物质的量浓度为1mol/L。现要求将上述混合溶液中K2SO4的浓度改为0.2mol/L,H2SO4的浓度改为2mol/L,应加入98%(密度1.84g/mL)的硫酸多少毫升?然后加水稀释到多少毫升?
28、(12分)用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ?⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2)经计算,需浓H2SO4的体积为
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤 2-3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度 处改用 加蒸馏水到瓶颈刻度的地方,使溶液的 ,振荡、摇匀后,装瓶、贴签。 (4)在配制过程中,其它操作都准确,下列操作中能引起误差偏高的有 (填代号)。
①利用量筒量取所需体积的浓硫酸时仰视刻度线
②洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
③等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
④将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥转移前,容量瓶中含有少量蒸馏水
⑦定容时,俯视标线
⑧定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
27.(8分)下图所示的实验装置可用来测定含两种元素的某种气体x的分子式。
在注射器A中装有240mL气体X慢慢通过 不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末。在C管中收集的无色液体是水;在注射器D中收集的气体是氮气。试回答下列问题:
(1)X气体是由____________和_________元素组成的。
(2)若240mLX气体完全反应后,收集到氮气的质量是0.28g。根据实验时的温度和压强计算1molX的气体的体积是24000mL,则X的摩尔质量是__________g/mol。
(3)通过计算,确定x的分子式为________。
(4)写出B中发生反应的化学方程式(x在该条件下不发生分解反应)
____________
26、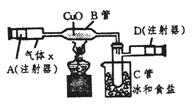 (6分),标准状况下,在干燥的圆底烧瓶中用向下排空气法收集氨气,所得瓶内气体对氢气的相对密度为9.5,如果将此烧瓶口向下倒置于水槽中(已知氨气极易溶于水),则进入水的体积占烧瓶容积的
,假设溶质全在烧瓶内,则所得氨水的物质的量浓度为
。用另一干燥的圆底烧瓶收集满气体做同样的实验,如果水充满了整个烧瓶,则所得氨水的物质的量浓度为
。
(6分),标准状况下,在干燥的圆底烧瓶中用向下排空气法收集氨气,所得瓶内气体对氢气的相对密度为9.5,如果将此烧瓶口向下倒置于水槽中(已知氨气极易溶于水),则进入水的体积占烧瓶容积的
,假设溶质全在烧瓶内,则所得氨水的物质的量浓度为
。用另一干燥的圆底烧瓶收集满气体做同样的实验,如果水充满了整个烧瓶,则所得氨水的物质的量浓度为
。
25.某学生用下列溶质配制一种混合溶液,已知溶液中[K+]=[Cl-]=1/2[Na+]=[SO42-],则选取的溶质可能是 ( )
A K2SO4和NaCl B.KCl、NaCl和Na2SO4
C.NaCl、Na2SO4和K2SO4 D. KCl、K2SO4和Na2SO4
23. 有m1gKCl饱和溶液,其质量分数为C1%;采取某措施后析出ngKCl(不含结晶水),滤液质量为m2g,质量分数为C2% 。下列关系错误的是 A. m1≥m2+n B. m1 C1-m2 C2=100n C. C1一定大于C2 D. 原条件下KCl的溶解度一定大于C1 g 24.用密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止。已知所生成的溶液的质量等于原BaCl2溶液的质量,则H2SO4溶液的浓度为( )
A. 21.9% B. 42.31% C. 13.5mol/L D. 5.67mol/L
22.已知某溶液的①体积 ②密度 ③溶质和溶剂的质量比 ④溶质的摩尔质量,要根据溶质的溶解度计算其饱和溶液的物质的量浓度时,上述条件必不可少的是( )
A.①②③④ B.①②③ C.②④ D.①④
21.有三种盐的混合溶液,其中含有Na+、Mg2+、SO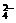 和Cl-,其物质的量分别为Na+0.2 mol、Mg2+0.25 mol、Cl-0.4 mol,则SO
和Cl-,其物质的量分别为Na+0.2 mol、Mg2+0.25 mol、Cl-0.4 mol,则SO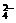 的物质的量为( )
的物质的量为( )
A.0.15 mol B.0.2 mol C.0.25 mol D.0.05 mol
20、常温下,在密闭容器中分别充入两种气体各0.1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的1/4。则原混合气体可能为( )
A.H2和O 2 B.HCl和NH3 C.H2和Cl2 D.CO和O2
19、常温常压下,24mL H2和O2的混合气体,点燃反应后再恢复到原来温度和压强,剩余气体体积为3 mL,则原混合气体中H2和 O2的分子个数比可能是( )
A.1:16 B.16:1 C.17:7 D.5:7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com