
题目列表(包括答案和解析)
1.下列反应既是氧化还原反应,又是吸热反应的是 ( )
A.铝片与稀H2SO4反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2反应 D.甲烷在O2中的燃烧反应
32.(1)实验室常用的浓盐酸密度为1.17g/mL、质量分数为36.5%。此浓盐酸的物质的量浓度为 mol/L。取此浓盐酸43mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为 mol/L。
(2)将4.8g镁投入此200mL稀盐酸中,反应后,求:
①放出的H2在标准状况下的体积。
②将生成的H2通过过量的灼热CuO,求被还原出的铜的质量。
③反应后(设溶液体积不变)溶液中两种阳离子的物质的量浓度之比。
31.今欲用NaOH晶体配制450mL 0.8mol/L的NaOH溶液。根据题意填空:
(1)配制该溶液应选用 mL容量瓶。
(2)用托盘天平称取 克固体NaOH。
(3)将称好的NaOH固体放至500mL的大烧杯中,倒入约300mL蒸馏水,用___搅拌至完全溶解。待 后,将烧杯中的溶液用玻璃棒引流转移至容量瓶中。
(4)用少量蒸馏水洗涤烧杯 次,洗涤液 轻轻晃动容量瓶,使溶液混和均匀。
(5)向容量瓶中加入蒸馏水,到液面 时,改用 加蒸馏水至液面与刻度线相切。盖好瓶塞 。
30.(2分)正常人的血液中葡萄糖(简称血糖,分子式为C6H12O6)的浓度在3.61-6.11mmol/L之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于____mmol/L,血糖属正常、偏高还是偏低? 。
29.(2分)铜和浓H2SO4共热,发生如下反应:Cu+2H2SO4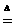 CuSO4+SO2↑+2H2O。该反应中氧化剂与还原剂的物质的量之比为
,还原产物是
。
CuSO4+SO2↑+2H2O。该反应中氧化剂与还原剂的物质的量之比为
,还原产物是
。
28.(9分)取少量Fe2O3粉末(红褐色)加入适量盐酸,发生的化学反应方程式为:
得到棕黄色的FeCl3溶液,用此溶液分别做如下实验。
① 取少量FeCl3溶液于试管,滴入几滴NaOH溶液,生成红褐色沉淀,发生的离子反应方程式为
② 在小烧杯中加入20mL蒸馏水,煮沸后,滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,即制得______。用激光笔照射烧杯中的液体,可以观察到液体中
。这个实验可用于区别 。
③取少量FeCl3溶液,加入过量铁粉,溶液由棕黄色变成浅绿色,经检验生成了FeCl2。写出反应的离子方程式: 。
27.(4分)从金属锌、氢气、氧气、水、一氧化碳、氧化铜、盐酸中任意挑选作为反应物,按下列要求写出化学方程式:
①既属于化合反应,又属于氧化还原反应:
②属于氧化还原反应,不属于置换反应、化合反应、分解反应、复分解反应:
26.(3分)下列物质:①水 ②醋酸 ③盐酸 ④烧碱 ⑤硝酸钾 ⑥酒精 ⑦汽油 ⑧蔗糖
(用编号回答)其中属于弱电解质的有 ;属于强电解质的有 ;强电解质在水中 电离。
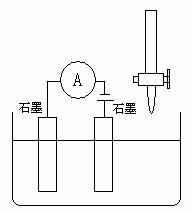
25. 下列哪种情况能使下图装置中的溶液导电性呈现“强-弱-强”变化的是:
A. 将50mL 0.1mol/L的H2SO4溶液慢慢加入50mL 0.1mol/L的Ba(OH)2溶液中; B. 将50mL 0.1mol/L的NaCl溶液慢慢加入50mL 0.1mol/L的AgNO3溶液中;
C. 在50mL 饱和澄清石灰水中通入CO2直至过量;
D. 在50mL 0.1mol/L的CH3COOH溶液中慢慢加入50mL 0.1mol/L的NaOH溶液
 第二卷
第二卷
|
24. 下列叙述正确的是
A. 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液。
B. 将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L。
C. 将wg a%的NaCl溶液蒸发掉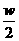 g水,得到2a%的NaCl溶液。
g水,得到2a%的NaCl溶液。
D. 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com