
题目列表(包括答案和解析)
2.下列物质是属于非电解质的是: ( )
A.CO2 B.(NH4)2SO4 C.Cl2 D.CH3COOH
1.下列基本反应类型中,一定是氧化还原反应的是: ( )
A.复分解反应 B.置换反应 C.分解反应 D.化合反应
20.(10分)达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式盐。
①取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全,则该碱式盐样品中氢氧根与碳酸根的物质的量之比
n(OH-):n(CO32-)= 。
②在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式为 。
19.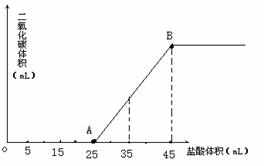 (10分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(10分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(1)写出OA段所发生反应的离子方程式:
;
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况)。
(3)计算原混合物中Na2CO3的质量分数为 。
18.(10分)钠是活泼金属,受热后与氧气剧烈反应,发出黄色火焰,生成一种淡黄色固体-过氧化钠。课本在生成物过氧化钠旁注明,指的“是反应的主要产物,由于空气中还有其它成分,因此可能还有一些同时发生的其它反应”。某校化学兴趣小组同学据此进行了有关探究。
[猜想]钠在空气中燃烧,生成过氧化钠、氧化钠,还有氮化钠。
[查阅资料]氮化钠与水反应能生成氢氧化钠和氨气。
[实验]①取11.5 g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠燃烧;
②将燃烧产物投入水中,得到0.224 L(折算成标准状态)气体和1000 mL溶液;
③经检验,该气体为纯净的氧气;
④从1000 mL溶液中取出25.00mL溶液,滴加2滴酚酞试液,加入1.00 mol·L-1HCl溶液至13.50 mL时恰好红色褪去。
[结论](1)通过计算确定钠的燃烧产物中是否含有氮化钠。
(2)计算钠在空气中燃烧产物中各成分的物质的量之比。
17.(10分)H2还原CuO反应不完全时,得到Cu、CuO、Cu2O的固体混和物,某化学兴趣小组同学为探究上述固体的成分进行了如下实验:
(1)取一定量的均匀固体混合物A,将其分成两等份。
(2)取其中一份用足量的H2还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀HNO3,固体恰好完全溶解,同时收集到标况下NO气体为2.24L。请回答下列问题:
(1)A中n(Cu)+n(Cu2O)= 。
(2) A中n(CuO)的取值范围是 。
(3)试计算所用稀HNO3的物质的量浓度。
16.(8分)2004年美国火星探测车在火星大气层中检测到了A气体。资料显示,A气体分子是一种三原子分子,其相对分子质量为60.0,在地球环境下A不太稳定,易分解得到一种单质和一种化合物。粉末状的KSCN与浓硫酸在一定条件下可得到气体A和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1
(1)试确定A的化学式 。
(2)写出KSCN与浓硫酸反应的化学反应方程式 。
(3)A分解得到一种单质和一种氧化物,写出A分解的化学反应方程式 。
15.(10分)某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
|
|
实验操作 |
实验现象 |
|
步骤1 |
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 |
有少量气泡产生,溶液的黄绿色褪去 |
|
步骤2 |
将第一份滤液与稀盐酸混合 |
产生大量气泡 |
|
步骤3 |
将第二份滤液加热 |
溶液变浑浊,且有大量无色气体产生 |
⑴ 步骤1中发生反应的离子方程式是______________________________________,过滤的目的是________________________________________________________。
⑵ 步骤2、步骤3的实验目的都是_____________________________,为达到该实验目的,还可以采取的方法是_____________________________________________。
⑶ 请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:_____________________________________________________。
14.5mLAg+浓度为0.1mol/L的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤、干燥称得质量为0.013g,则此沉淀是( )
A、LiF B、LiCl C、AgF D、AgCl
第II卷(选择题)共58分
13.工业上以CuO和H2SO4为原料制备CuSO4·5H2O晶体。为确保制备过程中既不补
充水,也无多余的水分,所用硫酸溶液溶质的质量分数应为( )
A.45.8% B.57.6% C.72.3% D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com