
题目列表(包括答案和解析)
18.(6分)(1)___________、__________,(2分) (2) __________ (2分) (3)______________________________。(2分)
17.(5分) ___________________________,(2分) _______________________________________,____________________________;(2分) ___________________________________________________________________。(2分)
24.(6分)将由KOH和Ca(OH)2组成的混合物为1.3 g 全部溶于一定量水中,配成稀溶液,再缓缓通入足量SO2,当生成沉淀质量刚好为最大值时,消耗SO2的体积为224 mL (本题中所有气体体积均为标准状况下测得),试解答下列问题。 (1)沉淀质量为______g ,混合物中m(KOH)=______g (2)若维持沉淀质量最大则通入SO2的体积的取值范围___________________________。
湖北省黄冈中学2008年春季高一化学期中考试试题答题卡
23.(6分)NO、NO2是大气污染物之一,目前有一种治理方法是在400℃左右,有催化剂存在条件下,用NH3将NO或NO2还原为N2和H2O,请写出NH3在上述条件下分别将NO、NO2还原成N2和H2O的化学方程式: _________________________________、____________________________________。 设某硝酸工业排放出的尾气中,只含NO和NO2且NO2和NO体积之比为3:1,现用氨还原法处理,上述尾气1体积需消耗相同状况下氨气_____________体积。
22. (12分)已知①②③④均为气体,⑤⑥为固体,它们之间有如下转换关系:
(12分)已知①②③④均为气体,⑤⑥为固体,它们之间有如下转换关系:

 (1)④的电子式是________,④的分子结构呈____________;
(2)①和②反应的化学方程式________________________________________,
(3)在下列方框中画出实验室制备④的发生装置示意图,与题给装置连成一完整装置图,并回答下列问题
① 实验室制备④反应的方程式:_______________________________;
② 烧杯中溶液由无色变红色,原因是(用离子方程式表示):
___________________________________________________________,
③ 在右图所示的烧瓶中充满气体④,将胶头滴管中水挤压2-3滴入烧瓶后,观察到的现象是__________________,这一现象说明④具有什么性质?____________。
(1)④的电子式是________,④的分子结构呈____________;
(2)①和②反应的化学方程式________________________________________,
(3)在下列方框中画出实验室制备④的发生装置示意图,与题给装置连成一完整装置图,并回答下列问题
① 实验室制备④反应的方程式:_______________________________;
② 烧杯中溶液由无色变红色,原因是(用离子方程式表示):
___________________________________________________________,
③ 在右图所示的烧瓶中充满气体④,将胶头滴管中水挤压2-3滴入烧瓶后,观察到的现象是__________________,这一现象说明④具有什么性质?____________。
21.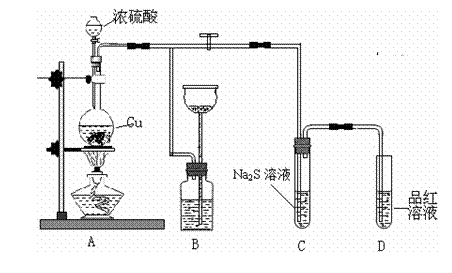 (8分)某化学兴趣小组为探究铜跟浓硫酸的反应,用下图装置进行有关实验。请回答下列问题:
(1)装置A中发生的化学反应的化学方程式为____________.
(2)装置B可作储气之用,称之为储气瓶,B中广口瓶内应盛放的液体是__(填序号)
①水 ②酸性KMnO4
③NaHCO3溶液 ④NaOH溶液
(3)装置C中观察到的现象______________,装置D中观察到的现象_______________。
(8分)某化学兴趣小组为探究铜跟浓硫酸的反应,用下图装置进行有关实验。请回答下列问题:
(1)装置A中发生的化学反应的化学方程式为____________.
(2)装置B可作储气之用,称之为储气瓶,B中广口瓶内应盛放的液体是__(填序号)
①水 ②酸性KMnO4
③NaHCO3溶液 ④NaOH溶液
(3)装置C中观察到的现象______________,装置D中观察到的现象_______________。
20.(9分)下图是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用作工业冶炼金属的还原剂。请按要求填空:
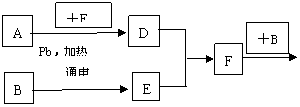
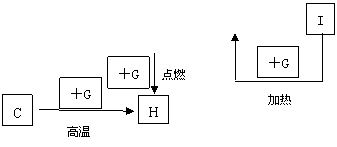
 (1)写出下列物质的化学式:
A.____________,B.____________,C.____________。
(2)写出A D的化学方程式:________________________________________。
(3)写出G和I的浓溶液反应的化学方程式:_______________________________。
(1)写出下列物质的化学式:
A.____________,B.____________,C.____________。
(2)写出A D的化学方程式:________________________________________。
(3)写出G和I的浓溶液反应的化学方程式:_______________________________。
(4)工业上制I的尾气中通常混有D和F, D和F都是大气污染物,工业上通常用苛性钠溶液来吸收尾气中的D和F,请写出相关的化学方程式:_________________________________、 ___________________________________________;要使D和F被完全吸收,其物质的量关系必须满足:______________________,为达到这个要求,可以向尾气中通入一定量的________来调节D和F的物质的量关系。
19.(4分)晶体硅是一种重要非金属材料。制备纯硅的主要步骤如下: ①在高温下,用碳还原SiO2制得含碳、脉石(主要成份为SiO2)等杂质的粗硅 ②将粗硅在高温下与Cl2反应生成SiCl4 ③将分馏提纯后的SiCl4用H2还原以得到高纯硅 用化学方程式表示上述制备过程 ①_______________________________________________________________________。 ②_______________________________________________________________________。 ③_______________________________________________________________________。 步骤③过程中所用H2,工业上可用粗硅与NaOH溶液反应制备,反应化学方程式为 _________________________________________________________________________。
18.(6分)在一定条件下,某短周期元素的氢化物X可完全分解为两种单质:Y和Z。若已知: ①反应前X与反应后生成的Z物质的量之比n(X):n(Z)=2:3 ②单质Y的分子为正四面体构型 请填写下列空白 (1)单质Y是______ , 单质Z是______(填写名称或分子式) (2)1 mol Y 分子中含______mol 共价键 (3)X分解为Y和Z的化学方程式:______________________________________。
17.(5分)将NaNO3晶体与浓H2SO4、铜屑混合共热,观察到的现象是________________, 反应方程式为_________________________、____________________________________。 若要鉴定KNO3稀溶液中含NO3-,应采用的操作方法是:__________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com