
题目列表(包括答案和解析)
25.(10分)某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有的离子是 ,一定不含有的离子是 ,还有一种离子不能确定是否存在,要检验这种离子的实验方法是
(填写实验名称),观察到的现象是 。请你写出步骤(4)中产生气体的离子方程式 。
24.(12分)硫酸是基础化学工业的重要的产品。它是许多化工生产的原料,大量用于制
化肥,如磷肥、氮肥等。某化学兴趣小组围绕浓硫酸及其盐的性质进行如下探究,请你回答:
(1)将适量的蔗糖放入一烧杯中,再加入浓硫酸,观察到蔗糖变黑,体积膨胀,并产生刺激性气味的气体。该实验表明浓硫酸具有 。(填序号)
A.强酸性 B.强氧化性 C.脱水性 D.吸水性
(2)取一小粒金属钠,小心放入盛有硫酸铜稀溶液的烧杯中,用漏斗倒扣在烧杯上,观
察到金属钠在液面上四处游动,有大量气泡生成,收集产生的气体并点燃,火焰呈淡蓝色,该气体是 (填化学式)。溶液中立即有蓝色沉淀生成,写出生成蓝色沉淀的离子方程式 。
(3) “绿色化学”要求综合考虑经济、技术、环保等方面来设计化学反应路线。若以铜为原料制取硫酸铜,通过以下两种方法均可以制得硫酸铜:
方法1:铜屑在空气中灼烧后,在加热条件下与稀硫酸反应。
方法2:铜与浓硫酸在加热条件下反应。请写出制取过程中发生反应的化学方程式。
方法1: 。 方法2: 。
从原料利用率、环境保护等角度对比,应该选用哪种方法 。
(4)明矾KAl(SO4)2·12H2O是一种很好的净水剂,请用简要的文字描述其原理 。
22.(8分)回答下列问题(填序号):
(1)下列仪器中:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥量筒⑦燃烧匙。
常用于物质分离的是 ,其中根据物质沸点不同来分离物质的仪器
是 。(用序号填写)
(2)今欲用NaOH固体配制500mL 0.2mol/L的NaOH溶液。根据题意填空:
A.配制该溶液应选用 mL容量瓶。
B.用托盘天平称取 g固体NaOH。
C.将称好的NaOH固体放至500mL的大烧杯中,倒入约250mL蒸馏水,用 搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
D.用少量蒸馏水洗涤烧杯2-3次,并将每次洗涤的溶液都注入容量瓶, 轻轻晃动容量瓶,使溶液混和均匀。
E.向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用 滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。如果加水时液面超过刻度线,将使配得的溶液浓度 (填“偏高”、“偏低”或 “无影响”)。
F.配制好的溶液 (填“能”或“不能”)长期存放在容量瓶中。
|
2FeSO4 ==== Fe2O3 +SO2↑+SO3↑ 为检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入右图所示的装置中,以检验产生的气体中是否含有SO2和SO3。请回答以下问题:
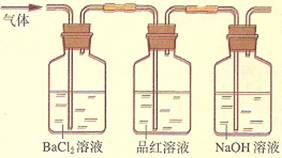
(1)写出用KSCN检验Fe3+的离子方程式 。
(2)操作②中氯化钡溶液中的现象是 。品红溶液的作用是 ,品红溶液中可观察到现象是 。
(3)操作②中最后要将通过品红溶液的气体再通入NaOH溶液中,这样做的目的是
,氢氧化钠溶液中发生反应的化学方程式为 。
21.(12分)学习化学应该明确“从生活中来,到生活中去”道理。在生产生活中,我们会
遇到各种各样的化学反应。请你写出下列反应的化学方程式。(注意反应条件并配平)
(1)已知氯化铁溶液跟铜反应生成氯化铜和氯化亚铁。电子工业常用30%的FeCl3溶液
腐蚀敷在绝缘板上的铜箔,制造印刷电路板 。
(2)玻璃中含有SiO2,不能用带磨口玻璃塞的试剂瓶保存碱性溶液的原因 。
(3)胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多 。
(4)在高温下一氧化碳与氧化铁反应可以制得金属铁 。
(5)将铁加入硫酸铜溶液中炼铜(湿法炼铜) 。
(6)工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉(主要成分是氯化钙和次氯酸钙) 。
20.湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体中可能有①Cl2,②NO2,③CO2,④SO2,⑤HCl,⑥溴蒸气中的( )
A.①③④ B.①②⑤ C.②④⑤ D.①②⑥
19.向盛有氯化铁溶液的烧杯中加入过量铜粉,反应结束后,溶液中大量存在的金属离子是( )
A.Fe3+ 、Fe2+ B.Fe2+ 、Cu2+ C.Cu2+ 、Fe3+ D.Cu+ 、Cu2+
18.同温同压下,A容器中H2和B容器中NH3所含氢原子数相等,则两个容器的体积比是( )
A.3:2 B.1:3 C.2:3 D.1:2
17.在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,氧化剂与被氧化HCl的物质的量之比为( )
A.1∶10 B.1∶8 C.1∶5 D.1∶1
16.下列除杂所选用的试剂及操作方法均正确的一组是( )
|
选项 |
待提纯的物质 |
选用的试剂 |
操作方法 |
|
A |
NaOH(Na2CO3) |
盐酸 |
- |
|
B |
CO2(CO) |
CuO |
加热 |
|
C |
Fe (Al) |
稀硫酸 |
过滤 |
|
D |
CO2(HCl) |
Na2CO3溶液 |
洗气 |
15.一定条件下,将一试管NO2倒立于水槽中,充分反应后剩余气体约为原体积的( )
A.1/5 B.1/4 C.1/3 D.1/2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com