
题目列表(包括答案和解析)
26.(8分)一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B (g) xC(g)。
xC(g)。
请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_________;x=________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是_________;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的关系式_________。
(2)若维持容器压强不变
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________molA气体和_________molB气体。
25.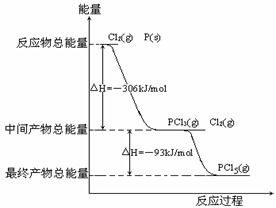 (8分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
(8分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
24.(12分)设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) △H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) △H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g) △H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) △H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
T/K |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g)  CO(g)+H2O(g) △H=Q3
CO(g)+H2O(g) △H=Q3
①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________________。
A.缩小容器体积 B.降低温度
C.使用合适的催化剂 D.设法减少CO的量 E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3=_____________;
 (3)现在恒容密闭容器中通入一定量CO2,再慢慢通入H2,使发生上述反应③,在其他条件不变时,若改变H2的起始量,容器中 CO的体积分数也随之改变,请在右图中画出CO的体积分数随n(H2)变化的示意图。
(3)现在恒容密闭容器中通入一定量CO2,再慢慢通入H2,使发生上述反应③,在其他条件不变时,若改变H2的起始量,容器中 CO的体积分数也随之改变,请在右图中画出CO的体积分数随n(H2)变化的示意图。
23.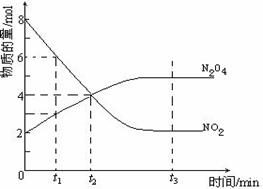 (12分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(g)
(12分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(g) N2O4(g),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(g),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动 (填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 (填“变深”、“变浅”或“不变”)
22.(10分)(1)中学化学实验中的中和热的测定所需的玻璃仪器除了大、小烧杯外还有
。在大、小烧杯间填满碎泡沫(或纸条)的作用是
。结合日常生活实际,该实验改在 中进行效果会更好。
(2)已知KI溶液在酸性条件下可被空气氧化生成碘单质。写出该反应的离子方程式
。现有1mol/LKI溶液、0.1mol/L硫酸溶液和淀粉溶液,某同学欲探究化学反应速率与温度的关系,请帮他设计实验:
21.(10分)依据事实,写出下列反应的热化学方程式。
⑴在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
⑵若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。____________________________________________________________________
⑶用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。___________________________________
⑷已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
(5)现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
____________
19.在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g) + O2(g)= 2H2O(g) △H1
2H2(g) + O2(g) = 2H2O(l) △H2
B.S(g) + O2(g) =SO2(g) △H1
S(s) + O2(g) = SO2(g) △H2
C.CO(g) + 1/2 O2(g) = CO2(g) △H1
2CO(g) + O2(g) = 2CO2(g) △H2
D.H2(g) +Cl2(g)=2HCl(g) △H1
2 H2(g) + 2 Cl2(g) =4 HCl(g) △H2
20. 某温度下,密闭容器中发生反应aX(g)
 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
A.可逆反应的化学计量数数:a>b+c
B.压缩容器的容积时,v正增大,v逆减小
C.达到新平衡时,物质X的转化率减小
D.达到新平衡时,混合物中Z的质量分数增大
18.下列方法中可以说明2HI(g) H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成2n
mol HI;②一个H–H键断裂的同时有一个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成2n
mol HI;②一个H–H键断裂的同时有一个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。
A、①⑦⑨ B、①④⑦⑧⑩ C、②③④⑤⑨ D、①②④⑦⑨
17.已知25℃、101kPa条件下:4Al (s) + 3O2 (g) = 2Al2O3 (s) △H = -2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H = -3119.91kJ/mol由此得出的结论正确的是
A.等质量的O2比O3能量低,由O2变O3 为吸热反应
B.等质量的O2比O3能量低,由O2变O3 为放热反应
C.O3比O2稳定,由O2变O3 为吸热反应
D.O2比O3稳定,由O2变O3 为放热反应
16.下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com