
题目列表(包括答案和解析)
3.实验室要用固体氯化钠试剂准确配制0.5 L 0.2 mol·L-1的NaCl溶液,下列哪种仪器不是必须使用的
A.500 mL容量瓶 B.胶头滴管 C.试管 D.托盘天平
2.以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是




A B C D
1.用如图所示的方法研究某气体的性质,这种方法属于
A.实验法 B.观察法 C.分类法 D.比较法
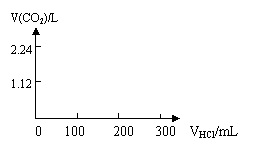
20、(14分)将碳酸钠与碳酸氢钠的混合物27.4g,加热到质量不再变化时剩余物质的质量为21.2g。将剩余的固体溶于水配成溶液,再向溶液中逐滴加入1mol/L的稀盐酸300mL,并不断搅拌使之充分反应。
⑴求混合物中Na2CO3和NaHCO3的质量;
⑵写出逐滴加入稀盐酸过程中的离子方程式:
⑶加完所有的盐酸后溶液中溶质的化学式和物质的量为:
⑷在图中画出生成CO2的体积(标准状况)与滴加盐酸体积之间的图象。
19、(8分)现有一含NaHCO316.8g的稀溶液(无其他杂质),若向其中加入某给定的物质,可将其转化为只含Na2CO321.2g的水溶液,有多种物质均可满足“给定物质”的条件,请完成下列小题。
⑴在实现上述转化的过程中,溶液中碳元素的质量 (填“增加、减少或不变”)。
⑵继续完成下表(可不填满,也可补充)
|
组号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
加入物质的化学式 |
Na2O2 |
NaH |
|
|
|
|
|
加入物质的质量(g) |
7.8 |
4.8 |
|
|
|
|
⑶已知反应NaH + H2O == NaOH + H2↑,反应中氧化产物和还原产物的物质的量之比为 。
18、(6分)⑴请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________→__________+__________+__________+H2O
⑵反应物中发生氧化反应的物质__________,被还原的元素是_________。
⑶反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
⑷请将反应物的化学式及配平后的系数填入下列相应的位置中:
__________+ __________→
17、(10分)已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应呈黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃。
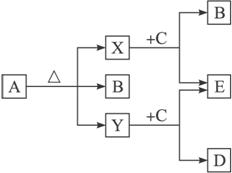
⑴写出下列物质的化学式:B____________,Y____________。
⑵写出A受热分解的化学方程式:____________________________________________。
⑶写出X和C反应的化学方程式: 。
(如本反应是氧化还原反应,需标出电子转移的方向和数目)
16、(7分)实验室欲用碳酸钠晶体(Na2CO3·10H2O)来配制500mL 0.1mol/L Na2CO3溶液。
⑴假定称得小烧杯的质量为 (填“32.6g”或“32.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码位置(画“ ▌”表示)(见下图)。
|
砝码质量/g |
50 |
20 |
20 |
10 |
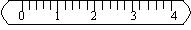 5 5 |
|
取用砝码过程 |
|
|
|
|
 |
⑵配制过程中,已有下列仪器: A、烧杯 B、量筒 C、胶头滴管
D、玻璃棒 E、托盘天平(含砝码)
根据实验的需要完成实验还缺少的仪器是
⑶在配制的转移过程中某学生进行如右图操作,请指出其中的错误:
、
⑷下列操作会使配制的溶液浓度偏低的是 (填字母)
A、没有将洗涤液转移到容量瓶 B、转移过程中有少量溶液溅出
C、容量瓶洗净后未干燥 D、定容时俯视刻度线
15、(7分)茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500克干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后加入盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6-7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30 min,加入9.01 g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液,消耗了0.1mol/LH2SO4 24 mL恰好和过量的碳酸钠完全反应。请回答下列问题
⑴步骤1中,使茶叶灰化需要三角架、泥三角、酒精喷灯、 、 等仪器。
⑵步骤2中,加入稀氢氧化钠溶液的目的为 。
⑶步骤2中,如何对所得沉淀进行洗涤
,如何检验沉淀已经洗涤干净
⑷步骤3中,500mL滤液中 CO32-的物质的量为______________mol,原茶叶中钙离子的质量分数为 。
14、下列离子方程式书写正确的是
A、将金属Na加入冷水中: 2Na+2H2O=2Na++2OH-+H2↑
B、在碳酸氢钙溶液中加入少量苛性钠溶液:
Ca2++HCO3-+OH-=CaCO3↓ +H2O
C、氢氧化钡溶液与稀硫酸的反应 Ba2+ + OH- + H+ + SO42- = BaSO4↓ + H2O
D、过氧化钠投入水中 Na2O2+H2O==2Na++2OH-+O2↑
第Ⅱ卷(非选择题 共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com