
题目列表(包括答案和解析)
21.(7分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸溜水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时为防止氧化需加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH 溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_______。
方法二:在右图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管I里加入的试剂是________。
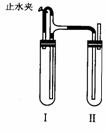 (2)在试管Ⅱ里加入的试剂是________。
(2)在试管Ⅱ里加入的试剂是________。
(3)为了制得白色Fe(OH)2沉淀,在试管I和Ⅱ中加入试剂,打 开止水夹,塞紧塞子后的实验步骤是________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________。
20.取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成2.016 L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33 g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少。
附加题(本大题3小题,共20分 )
 19.某溶液中含有Ba2+,Cu2+, Ag+,现用NaOH溶液、
19.某溶液中含有Ba2+,Cu2+, Ag+,现用NaOH溶液、
盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。
其流程图如右
 (1).沉淀的化学式:白色沉淀1
,
(1).沉淀的化学式:白色沉淀1
,
蓝色沉淀2 ,
白色沉淀3 ;
(2).写出混合液+A的离子方程式

溶液+B的离子方程式
18.① A、B、C、D四种物质均含有元素X,有的还可能含有元素Y或者Z。元素Y、X、Z的核外电子数依次增加。
② X在A、B、C、D中的化合价分别为0、-1、+1、+5。
③ 室温下单质A与含有Z元素的常见一元强碱溶液反应,可得到B和C。
④ 化合物D受热催化分解,可制得元素Y的单质。
请回答下列问题:
(1)写出元素X、Y、Z的元素符号:X: ,Y: ,Z 。
(2)写出A、B、C、D的化学式:A ,B ,D 。
(3)写出③中反应的化学方程式 。
(4)写出④中反应的化学方程式并标明电子转移的数目和方向 。
17.(6分)(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:__________ 。
(2)在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
__________ 。
16.(7分)(1)48.3g Na2SO4·10H2O中所含的Na+的质量是 ,SO42-的物质的量是 ,所含H2O分子的数目是 个。
(2)在sīO2+2C sī+2CO
sī+2CO 反应中:
是氧化剂,
是还原剂, ------------------元素被氧化, 元素被还原(4分)
反应中:
是氧化剂,
是还原剂, ------------------元素被氧化, 元素被还原(4分)
15.取两份等量的铝粉,分别与足量的盐酸和足量的浓氢氧化钠溶液反应,在相同状态下产生气体的体积之比是
A.1:1 B.1:2 C. 1:3 D. 3:2
第Ⅱ卷 (非选择题,共40分)
14.只用一种试剂就能把Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是……….………………………………………………………….……….
A.AgNO3 B.NaOH C.BaCl2 D.Ba(OH)2
13.CO和H2混合气体10克。在足量氧气中燃烧后,在150℃时将所得气体通过足量的过氧化钠,过氧化钠增重的质量为
A、5g B、10g C、3g D,无法计算
12.在无色透明溶液中,能大量共存的离子组是AC
A.Cu2+、Na+、SO42-、Cl- B.H+、Na+、HCO3-、NO3-
C.OH-、HCO3-、Ca2+、Na+ D.Ba2+、Na+、OH-、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com