
题目列表(包括答案和解析)
27.(8分)已知A、B为气体单质,其中A为黄绿色气体,B为无色气体; C为化合物,其水溶液的pH小于7;D为金属单质,它们之间有下列转化关系:

(1)试写出A、B、C、D的化学式:
A_________;B_________;C___________;D_________。
(2)写出C的水溶液与D反应的离子方程式:______________;
F+D反应的离子方程式:__________________________。
26.(4分)某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有 离子,一定不含有 离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程) 。
25.(11分)含镁3%-5%的铝镁合金,现已成为轮船、化工、机械制造等行业的重要原材料。现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案。

 实验设计1:铝镁合金 测定生成气体的体积(标准状况)
实验设计1:铝镁合金 测定生成气体的体积(标准状况)
实验设计2:铝镁合金 测定生成气体的体积(标准状况)
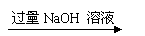
 实验设计3:镁铝合金 溶液
过滤,测定沉淀的质量
实验设计3:镁铝合金 溶液
过滤,测定沉淀的质量
回答下列问题:
(1)写出实验设计2、3方案中有关单质铝的化学反应方程式 ; ;
(2)若按实验设计3进行实验,实验过程需要的主要仪器有
(写出3种仪器名称)。将m g镁铝合金,溶于过量盐酸中,再加入过量的NaOH溶液,可得到白色沉淀,该沉淀物质是 (填化学式);将此沉淀洗净、干燥后,称得质量为w g。求合金中镁的质量分数 ;
(3)下列各实验方案中,能测出合金中镁的质量分数的是 。
A..实验设计1 B.实验设计2 C.实验设计3 D.都可以
24.(6分)已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O====K2SO4+2MnSO4+2H2SO4
用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2

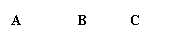
①实验时,反应产生的气体应从 端通入; 从 端连接盛有澄清石灰水的实验装置(用 “a”或“b” 填空)。
②可观察到A瓶的溶液 。
③C瓶溶液的作用是 。
23.(10分)钠、铝、铁是三种重要的金属。请回答:
(1)钠元素的金属性比铝的 (填“强”或“弱”)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为 ;可观察到的实验现象是 (填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)Fe跟Cl2在一定条件下反应,所得产物的化学式是 。将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成 色。
b.向另一支试管中滴加NaOH溶液,现象为 ,反应的离子方程式是______________。
22.(6分)汽车尾气产生的NO2、CO等大气污染物,可以在催化剂的作用下转化为无毒物。其反应式可表示为:
2NO2 +4CO === N2 +4CO2 。
①用双线法标出上述反应电子转移的方向和数目:
②该反应中氧化剂是________,还原剂是________,每有28g N2生成,反应中转移的电子为_____mol。
21.(6分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
20.“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。若以铜为原料制取硫酸铜或硝酸铜,下列设计你认为符合“绿色化学”思想的反应路线(用化学方程式表示)是( )
A.制CuSO4:Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
B.制CuSO4:2Cu + O2 = 2CuO;
CuO + H2SO4(稀) = CuSO4 + H2O
C.制Cu(NO3)2:Cu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+ 2H2O
D.制Cu(NO3)2:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O
19.制备粗硅的反应为:SiO2+2C Si+2CO↑,其中氧化剂与还原剂的物质的量之比为 ( )
A.1 : 3 B.3 : 1 C.1 : 2 D.2 : 1
18.对下列物质进行的分类正确的是
A.纯碱、烧碱均属于碱
B.CuSO4·5H2O属于纯净物
C.凡能电离出H+的化合物均属于酸
 D.盐类物质一定含有金属阳离子
D.盐类物质一定含有金属阳离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com