
题目列表(包括答案和解析)
12、(1)a、c(2)2Na2O2 + 2H2O = 4NaOH + O2↑
(3)①用带火星的木条放于导管P口处,将导管q插入盛水的烧杯中。
②若带火星木条复燃,则证明有氧气生成;若q导管口处有气泡逸出,则证明该反应为放热。
11、(1)银白,Na2O (2)因煤油易燃,防止引燃钠表面的煤油 (3)镊子,手指表面有水分与钠反应生成氢氧化钠而腐蚀皮肤。(4)钠与水反应放热,钠的熔点低,密度小于水。(5)红色,钠与水反应生成了氢氧化钠。
1、A2、C3、C4、B5、A6、B7、D8、B9、B10、A
(二)基础训练
1、“绿色化学”要求从根本上减少及杜绝污染,下列对农作物收割后留下的秸杆的处理方法中,不符合“绿色化学”的是 ( )
A、就地焚烧 B、发酵后作农家肥 C、加工成精饲料 D、制造沼气
2、近代化学诞生的标志是 ( )
A、1803年原子学说的建立 B、1869年元素周期表的发现
C、1661年提出了化学元素的概念 D、1771年氧化学说的建立
3、下列不属于未来化学探索空间的是 ( )
A、 能源和资源的合理开发 B、合成新材料,制备新物质
C、 寻找新物种 D、为治理环境找到快速灵敏的检测手段,并提出防护措施
4、下列说法正确的是 ( ) A、化学是科学家研究的内容,与普通百姓没有关系
B、化学家可以制造出自然界中不存在的物质
C、化学研究只会造成严重的环境污染,最终人类将毁灭在化学物质中
D、研制艾滋病疫苗的过程中,化学将不会起到作用
5、下列有关钠的化学性质的叙述正确的是 ( )
A、钠与水反应生成氢氧化钠和氢气
B、钠在空气中燃烧生成白色的过氧化钠
C、钠与氧气、氯气、硫等非金属都能发生反应,但不能和水反应
D、钠与硫酸铜溶液反应可以置换出金属铜,但没有其他单质生成。
6、下列叙述中错误的是( )。
A、 钠在空气中燃烧是发出黄色火焰 B、 钠在空气中燃烧生成氧化钠
C、 钠在与水反应时浮于水面并迅速游动 D、 钠较软,能用小刀切割
7、下列各组物质中,反应后生成碱和氧气的是( )。
A、 Na和H2O B、 Na2O和H2O C、CaO和H2O D、 Na2O2和H2O
8、下列关于钠的说法正确的是( )。
A、钠是银白色金属比水的密度略大 B、通常状况下,钠的熔点低于水的沸点 C、钠在空气中缓慢氧化生成Na2O2 D、钠着火时可用水扑灭。
9、实验室里做钠跟水反应的实验时,用到的仪器和药品是 ( )
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤研钵 ⑥烧杯 ⑦坩埚 ⑧石棉网 ⑨玻璃片 ⑩药匙
A、①②③④ B、②③④⑥⑨ C、③④⑧⑨⑩ D、②⑤⑦⑨⑩
10(选做)、将23 g钠和24 g镁分别放入等质量的过量的稀硫酸中,得到溶液的质量分别为a g和b g (设反应中水分不损失)则a和b的关系为 ( )
A、a =b B、a>b C、a<b D、无法确定
11、在进行钠和水的反应实验中,有如下操作和实验现象,请根据钠的性质解释说明:
(1)刚用小刀切开的金属钠断面呈 色,在空气中放置几分钟后发生的变化生成 。
(2)切下来的金属钠要用滤纸擦净后方可放入水实验,因为
。
(3)金属钠必须用 夹取,而不直接用手拿取。理由是
。
(4)金属钠投入水中后,钠很快熔化成一个闪亮的小球并浮在水面上,因为
(5)钠球在水面上四处游动,并发出嘶嘶的响声,因为
(6)若水中在未加入钠之前滴入酚酞试剂,反应后溶液变为 色,理由
。
12、用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是 :
(a)反应放热 (b)棉花在空气中可以自燃
(c) 有O2生成 (d)Na2O2在空气中可以自燃
(2)写出Na2O2和H2O反应的化学方程式
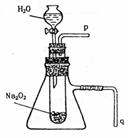 (3)某学校研究性学习小组拟用下图装置进行实验,以证明上述结论。
(3)某学校研究性学习小组拟用下图装置进行实验,以证明上述结论。
①用以验证结论的实验操作方法是:
②用以验证结论实验现象是:
13、将0.46克钠置于100 mL0.1 mol/L的盐酸溶液中,完全反应后,请计算生成NaCl的物质的量和标准状况下氢气的体积?
14(选做)、有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管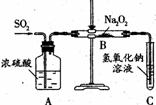 C中,木条复燃。
C中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成Na2SO3和O2,该反应的化学方程式是: 。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。 。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。
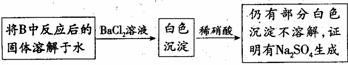 为检验是否有Na2SO4生成,他们设计了如下方案:
为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理? ,请简要说明两点理由:
① ,② 。
(一)重要知识点回顾
1.研究物质的性质通常运用 、 、 、 等方法。2.金属钠主要化学性质(1)与水的反应
|
现象 |
分析(或结论) |
|
金属钠浮在水面上 |
|
|
金属钠迅速融化成球状 |
|
|
球状的金属钠四处游动并发出咝咝响声 |
|
|
球状的钠消失,溶液中滴入酚酞溶液变红色 |
|
|
将收集的气体点燃,发出“噗”声或有轻微的爆鸣声 |
|
|
反应(写出离子方程式): |
(2)与氧气的反应
|
实验内容 |
实验现象 |
化学反应方程式 |
|
金属钠在空气中放置 |
|
|
|
在空气中加热金属钠 |
|
|
3.过氧化钠的主要化学性质
过氧化钠分别与水、二氧化碳反应的化学方程式:
并指出两反应中氧化剂、还原剂(选做)
33.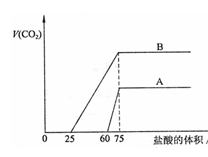 取等物质的量浓度的NaOH溶液两份A
取等物质的量浓度的NaOH溶液两份A
和B,每份50mL,向其中各通入一定量的CO2,
然后各取溶液10mL,分别将其稀释为100mL,
分别向稀释后的溶液中逐滴加入0.1mol/L的
盐酸,标准状况下产生CO2气体体积与所加盐
酸体积之间的关系如下图所示,试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为) , ,两种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为 , ,两种溶质物质的量之比为 ;加盐酸后产生CO2体积最大值 mL。
(3)通过计算求NaOH溶液的物质的量浓度。

32.将50mL 0.1mol/LBaCl2溶液与100mL0.75mol/L H2SO4溶液混合,求:
(1)反应产生沉淀的质量是 g;(保留2位有效数字)
(2)若不考虑溶液体积的变化,则反应后溶液的C(H+)为 。
31.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的物质之间的变化:
据此判断:
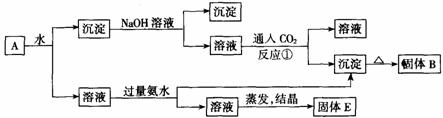
(1)固体B所含物质的化学式为______________;
(2)固体E所含物质的化学式为______________;
(3)反应①的离子方程式为____________ 。
30.铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的程式为:
Fe(NO3)+NaOH+Cl2─Na2FeO4+NaNO3+NaCl+H2O ,则反应中 元素被氧化。
29.化学反应中,如果给原子核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:原子核对核外电子的吸引力;形成稳定结构的倾向。下表是一些周期表中1-18号元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
① 通过上述信息和表中的数据分析:为什么锂原子失去核外第二个电子时所需的
能量要远远大于失去第一个电子所需的能量: ;
②在一定条件下,表中X可能与氢气反应的化学方程式是 ;
③Y元素常见的化合价可能是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com